
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
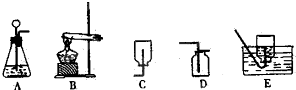
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
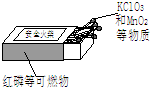 (1)用纳米级的某种氧化物做催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体.写出CO和NO反应的化学方程式2CO+2NO$\frac{\underline{\;纳米级的某种氧化物\;}}{\;}$2CO2+N2.
(1)用纳米级的某种氧化物做催化剂,使汽车尾气中的CO跟NO反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的气体.写出CO和NO反应的化学方程式2CO+2NO$\frac{\underline{\;纳米级的某种氧化物\;}}{\;}$2CO2+N2.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe3+ SO42- H+ Cl- | B. | Mg2+ Cl- OH- Na+ | ||
| C. | Ca2+ CO32- NO3- Na+ | D. | H+ Na+ Ag+ NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com