
【题目】侯氏制碱法的主要反应如下:
① NH3 + CO2 + H2O NH4HCO3 ②NH4HCO3 + NaCl NH4Cl + NaHCO3
某温度下,向105 g饱和NaCl溶液中,通入适量氨气(NH3)和CO2,通过上述反应可制得NaHCO3晶体。
(1)已知①中参加反应的NH3质量为3.4 g,则消耗CO2的质量是多少?
(2)反应后称量溶液中析出NaHCO3晶体的质量为9.7 g,则剩余溶液的质量是多少?
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】下列实验方法不能达到实验目的的是
A.用肥皂水鉴别硬水和软水 B.通过观察颜色区别铁丝和铝丝
C.用水区分氯化钠固体和硝酸铵固体 D.通过闻气味区分二氧化硫和二氧化碳
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类通过化学反应获得大部分能量。
(1)家用燃料天然气的主要成分是甲烷,其完全燃烧的化学方程式为 。
(2)火箭用联氨(N2H4)做燃料,用四氧化二氮助燃,联氨中氮、氢元素的质量比为 。
(3)下列燃料属于有机物的是 。
A.CO B.H2 C.CH4 D.C2H5OH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 20℃时,将等质量不含结晶水的甲、乙固体分别加入到盛有100 g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙固体的溶解度曲线如图3。下列说法错误的是
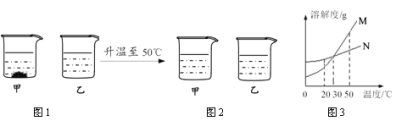
A.图1中,甲一定是饱和溶液
B.图2中,两溶液中溶质的质量分数一定相等
C.图3中,N表示甲的溶解度曲线
D.图2中,两溶液降温至30℃一定都不会析出晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:

(1)用上图的序号表示配制溶液的正确操作顺序为_____。
(2)操作③用玻璃棒搅拌的目的是 。
(3)称量NaCl时,天平平衡后的状态如图所示,游码标尺示数见下图,则需要量取水的体积是 (水的密度为1 g/mL)。
![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(2分)N(NO2)3 是一种新型火箭燃料,请计算。
(1)N(NO2)3的相对分子质量为 。
(2 N(NO2)3中氮原子和氧原子的个数比为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法中错误的是
A.同种分子构成的物质是纯净物
B.原子是化学变化中的最小粒子
C.同种元素组成的物质是单质
D.元素的化学性质与该元素的原子的最外层电子数关系最密切
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl、Na2CO3、NaHCO3、CaCO3是生活中常见的盐,为学习鉴别他们的方法,老师拿来了标有A、B、C、D的这四种白色固体,并提供以下资料。
查阅资料:(1)Ca(HCO3)2可溶于水
(2)NaHCO3![]() Na2CO3 + H2O + CO2↑;Na2CO3的热稳定性好,受热不分解。
Na2CO3 + H2O + CO2↑;Na2CO3的热稳定性好,受热不分解。
(3)不同温度下,Na2CO3、NaHCO3的溶解度如下表:

设计方案:为完成鉴别,同学们分别设计了自己的实验方案

(1)小芳的实验中,步骤1鉴别出来的物质是__________。
(2)小明和小刚的步骤1都是溶解,该步实验的目的是__________。
进行实验:小刚的步骤1溶解的具体操作为 ;小刚在进行步骤2时,发现在两只试管中产生了白色沉淀,小刚推测它们是Na2CO3、NaHCO3。则NaHCO3与石灰水反应的产物可能是__________。(用化学方程式表示)
反思与评价:(1)小刚的设计能不能完成鉴别,理由是__________。
(2)小丽觉得大家的方案太麻烦,她跟老师要了一些氯化钠,做了下图所示的实验,由该实验得出的结论是__________。在此实验基础上,小芳用一步完成了鉴别,她的实验方法是__________。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
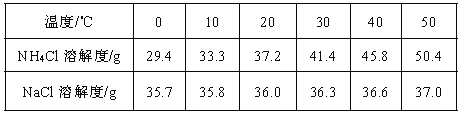
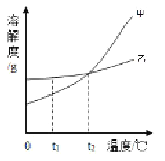
(1)氯化钠的溶解度曲线是 (填“甲”或“乙”)。
(2)20℃时,将40gNH4Cl 加入100g 的水中,充分搅拌后得到的是 溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为 (只列计算式,不需计算结果)。
(3)如图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g 水,析出晶体最多的是 (填“甲”或“乙”)。
(4)计算配制50g 质量分数为3%的NaCl 溶液所需要质量分数为6%的NaCl 溶液的体积,需要用到的数据是 。
A.3%的NaCl 溶液的密度 B.水的密度 C.6%的NaCl 溶液的密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com