
分析 根据NaCl溶液中所含有的少量MgCl2、CaCl2和MgSO4杂质,选择除杂试剂,选择的除杂试剂与杂质反应时要求不能生成新的杂质,选择的除杂试剂需要含有能与镁离子、钙离子、以及硫酸根离子结合产生沉淀,且后加的试剂能将上一步过量的试剂反应掉.
解答 解:(1)要除去MgCl2、CaCl2和MgSO4杂质,就是除去Mg2+、Ca2+和SO42-,可以分别选用OH-、CO32-和Ba2+除去,选择的除杂试剂与杂质反应时要求不能生成新的杂质,后加的试剂能将上一步过量的试剂反应掉,可以选用的物质分别是氯化钡、碳酸钠、氢氧化钠以及盐酸,所以A是BaCl2,B是Na2CO3,C是NaOH,D是HCl;(2)为了充分除去SO42-,需要加入过量的氯化钡,氯化钡能与硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;(3)为了除去Ca2+和上一步过量的钡离子,需要加入过量的碳酸钠,碳酸钠能与氯化钡反应生成碳酸钡沉淀和氯化钠,能与氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl,BaCl2+Na2CO3══BaCO3↓+2NaCl;(4)步骤四中,判断所加的试剂D为“适量”的方法是不再有气泡产生;(5)步骤一、二、三的顺序能交换,只需要将碳酸钠放在氯化钡之后,所以可以是1、2、3,1、3、2,3、1、2三种.给答案为:(1)BaCl2,Na2CO3,NaOH,HCl;(2)除去硫酸钠,Na2SO4+BaCl2=BaSO4↓+2NaCl;(3)除去氯化钙和反应剩余的氯化钡,CaCl2+Na2CO3═CaCO3↓+2NaCl,BaCl2+Na2CO3══BaCO3↓+2NaCl;(4)不再有气泡产生;(5)1、2、3,1、3、2,3、1、2三种.
点评 本题考查了物质的除杂,完成此题,要求选择的除杂试剂与杂质反应时要求不能生成新的杂质,且后加的试剂能将上一步过量的试剂反应掉.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
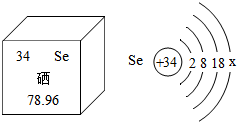 硒是人体生命活动中必需的微量元素之一,是人体内的抗氧化剂,能提高人体免疫力,具有多种生物功能,硒被誉为“抗癌大王”.如图提供了硒的有关信息,下列说法中,正确的是( )
硒是人体生命活动中必需的微量元素之一,是人体内的抗氧化剂,能提高人体免疫力,具有多种生物功能,硒被誉为“抗癌大王”.如图提供了硒的有关信息,下列说法中,正确的是( )| A. | 硒的相对原子质量是78.96,硒属于金属元素 | |
| B. | 硒原子序数和原子核内中子数均为34 | |
| C. | 硒原子和硫原子化学性质相似,其Se2-的核外电子数为36 | |
| D. | 硒元素对人体有那么多的好处,其补充多多益善 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 露置在空气中的浓硫酸质量增加了 | |
| B. | 加热铜与浓硫酸放出有刺激性气味的气体 | |
| C. | 伸入浓硫酸中的木炭一会儿变黑了 | |
| D. | 浓硫酸不能用来干燥碱性气体:NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com