
【题目】菱锰矿(MnCO3)的重要用途之一是制备锰的氧化物。已知不同温度下,在空气中加热菱锰矿,将得到固体(锰的氧化物)并放出CO2。下图为兴趣小组在某温度下、于空气气氛中加热MnCO3所得到的固体质量(m)和加热时间(t)关系图。下列说法错误的是

A. Y点时MnCO3已反应完全
B. 所得固体物质的化学式为MnO2
C. 固体产物中锰元素质量为5.5g
D. MnCO3加热得到锰的氧化物过程中氧气参加了反应
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:初中化学 来源: 题型:
【题目】两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图一所示,结合图二判断下列说法正确的是( )

A.Y的溶解度曲线为b曲线 B.降温可使X的饱和溶液变浑浊
C.X的饱和溶液从t2℃降温到t1℃,溶质的质量分数变大
D.t3℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有A~F六种物质,已知A、B、C三种固体含有同种金属元素,A是大理石、石灰石的主要成分,B是一种氧化物能与E反应放出大量的热,D、E、F含有同种非金属元素,E通常状况下为液体,D、F通常状况下为气体,且F为单质。它们的转化关系如图(部分产物已略去)。温馨提示:图中“→”表示箭尾的物质可转化成箭头的物质;“﹣”表示两端的物质能发生化学反应。
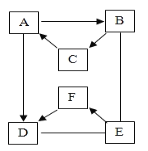
(1)写出A、E物质的名称:A_____,E_____。
(2)写出C→A的化学方程式:_____。
(3)写出E→F的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某品牌豆浆机的示意图,请回答下列问题:

(1)所标物质中含有金属材料的是___(填一种,下同),含有合成材料的是____。
(2)豆浆是深受中国人民喜爱的饮品,在欧美享有“植物奶”的美誉,其含有丰富的___(填字母)。
A 油脂 B 蛋白质 C 糖类
(3)豆浆机中的刀片采用不锈钢制造,与采用纯铁制造相比较,不锈钢具有___等优良的性能。
(4)写出用稀盐酸除铁锈的反应的化学方程式:___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包固体粉末,可能含有铜、氧化铁、氯化钠、硫酸钠、硫酸铜中的一种或几种,为确定其成分,进行了如下实验,现象如图所示(部分生成物未标出,假设各步都恰好完全反应):
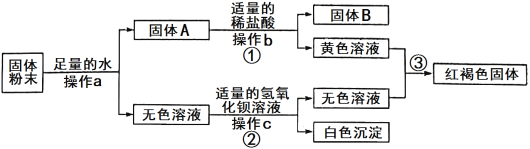
根据实验过程中的现象判断:
(1)操作a、b、c相同,其名称是__________。
(2)固体B的成分是________(填化学式),写出反应③的化学方程式:______________________。
(3)原固体粉末的成分可能有_______种情况。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废旧锌锰电池中的黑锰粉主要成分是MnO2和NH4Cl,以及少量ZnCl2、炭黑和氧化铁等。下图是以黑锰粉为原料制备MnCl2,实现锰的再利用的工作流程:
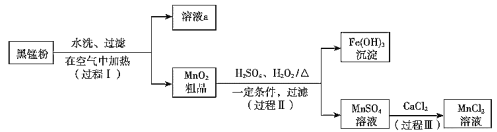
(1)过程1,在空气中加热黑锰粉的主要目的是除炭,除炭的化学方程式是_____________ 。
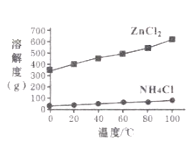
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。根据如图所示的溶解度曲线,将溶液a加热蒸发浓缩、________、过滤可得NH4Cl粗品。
(3)过程Ⅱ的目的是:①将MnO2转化为 MnSO4溶液;②将Fe2O3转化为Fe(OH)3沉淀。①和②的转化中化合价有变化的是______(填①或②)。
(4)过程Ⅲ发生复分解反应,该反应的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】没有水就没有地球上的生命,人类的日常生活离不开水。
(1)日常生活中常用的净化水的操作有沉淀、过滤、吸附、蒸馏等,其中能把硬水软化的操作是_________。
(2)写出电解水的化学反应方程式:___________;该反应的基本类型是_____。
(3)A、B、C三种固体的溶解度曲线如图所示:①P点的含义是______________;②t1℃时,将10gA物质加入50g水中,充分溶解后,形成溶液的质量为____ g;
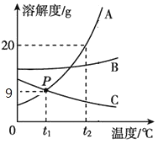
③t2℃时,将A、B、C物质饱和溶液各100克,分别蒸发10克水后,剩余溶液质量分数由大到小的顺序是________。
(4)氢氧化钠是实验室中常见的碱,现用氢氧化钠固体配制溶质质量分数为40%(密度为1.43g/mL)氢氧化钠溶液100mL,过程如下:
①计算:需称量氧氢化钠固体__________ g,加水体积为___________mL。
②称量:如图称量氢氧化钠固体的操作中,有一处明显错误是________________________。
③溶解:将正确操作称量好的氢氧化钠固体加入烧杯中,并将量取的蒸馏水倒入烧杯中,并用玻璃棒搅拌,使它完全溶解。经检测,所配制溶液的溶质质量分数偏小,其原因可能是_________(填序号)。

①氢氧化钠固体不纯 ②量取水时,俯视读数
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学基础与常识
(1)下图金属应用的实例,主要利用金属的导热性的是_______(填序号);

A电缆 B.电热壶 C.金属丝 D.金属乐器
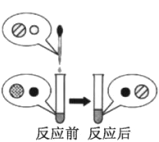
(2)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中“○”“![]() ”“●”“
”“●”“ ![]() ”表示不同离子)。则“○”与“
”表示不同离子)。则“○”与“![]() ”反应生成了_________(填物质名称)。
”反应生成了_________(填物质名称)。
(3)氢氟酸(HF)能刻画玻璃,其中有一个化学反应的化学方程式是:CaSiO3+6HF=X+SiF4↑+3H2O,则X的化学式为_______________
(4)氢能是一种极具发展潜力的清洁能。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。
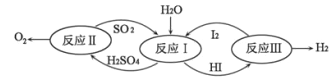
写出反应I中,发生反应的化学方程式:_____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】被国外友人称作“新四大发明之一”的高铁,大大方便人们的出行。

(1)图中标示的物质中为金属材料的是______(填序号),动车电路中的导线大多选用铜制造的,这是利用了铜的延展性和__________性。
(2)动车表面喷漆主要是为了防止外壳生锈,其原理是________。
(3)修建铁路所需的大量钢铁是以铁矿石为主要原料冶炼而得。写出一氧化碳和赤铁矿炼铁的化学方程式:_______________。
(4)已知M、N、R三种金属存在如下反应:R+NCl2=== N+RCl2;M+RCl2===R+MCl2,M、N、R三种金属的活动性由强到弱的顺序为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com