
| A. | 南北两极冰川融化 | B. | 江河中沙石迁移 | ||
| C. | 地下石油的形成 | D. | 天上云雨转移 |
分析 本题考查学生对物理变化和化学变化的确定.判断一个变化是物理变化还是化学变化,要依据在变化过程中有没有生成其他物质,生成其他物质的是化学变化,没有生成其他物质的是物理变化.
解答 解:A、南北两极冰川融化是由固态变为液态,只是状态发生了变化,属于物理变化,故A错;
B、江河中沙石迁移只是位置的移动,属于物理变化,故B错;
C、地下石油的形成是经过非常复杂的化学变化,形成的,属于化学变化,故C正确;
D、天上云雨转移只是状态的变化,属于物理变化,故D错.
故选C.
点评 搞清楚物理变化和化学变化的本质区别是解答本类习题的关键.判断的标准是看在变化中有没有生成其他物质.一般地,物理变化有物质的固、液、气三态变化和物质形状的变化.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题

| A. | 属于非金属元素 | B. | 相对原子质量为58.93g | ||
| C. | 钴原子中有27个中子 | D. | “CO”和“Co”表示的意义截然不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如右图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.
某化学课外小组的同学,为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如右图所示的装置(图中铁架台已经略去),实验在27℃,101kPa下进行.| 实验步骤 | 实验现象 | 实验结论 |
| 1.取样,溶于水,滴加过量的氯化钙溶液 | 产生白色沉淀 | 氢氧化钠部分变质 |
| 2.静置,向上层清液中滴加酚酞溶液 | 变红 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 生活中的现象 | 解释 | |
| A | 春暖花开,香气宜人 | 分子在不断运动 |
| B | 洗洁精清洗餐具上油污 | 洗洁精能溶解油污 |
| C | 铁制品在潮湿地方易生锈 | 铁生锈过程是铁与氧气、水发生复杂的化学反应 |
| D | 活性炭用作冰箱去味剂 | 活性炭具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 化学符号 | 2H | 2N2 | Mg2+ | H2O | 2CO32- | 2H2 |
| 符号的 意义 | 2个氢原子 | 2个氮分子 | 镁离子 | 水 | 2个碳酸根离子 | 2个氢分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用 | |
| B. | “温室效应”主要是由CO2等气体引起的 | |
| C. | pH<5.6的酸性降水称为酸雨,我国某些地区酸雨的形成主要与大气中SO2等污染物增多有关 | |
| D. | 使用乙醇汽油能减少有害气体的排放,节约石油资源,促进农业生产 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用灼烧闻气味的方法鉴别纯棉和羊毛 | |
| B. | 用活性炭头吸附降低水的硬度 | |
| C. | 将煤球制成“蜂窝煤”,使其燃烧更充分 | |
| D. | 用可降解塑料代替传统塑料,以减少“白色污染” |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
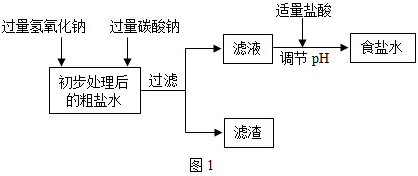
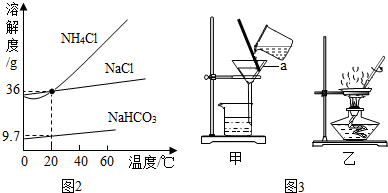
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com