
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加稀盐酸 | 没有气泡产生 | 滤渣中不含有铁 |
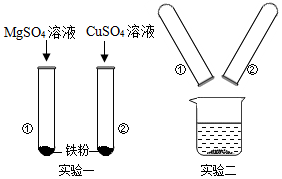
分析 镁比铁活泼,铁比铜活泼;
铁和硫酸铜反应生成硫酸亚铁和铜;
稀盐酸能和铁反应生成氯化亚铁和氢气.
解答 解:(1)铁和硫酸铜反应生成硫酸亚铁和铜,发生反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
①中无明显现象,说明镁比铁活泼,②中产生红色固体,说明铁比铜活泼,该实验得出三种金属的活动性由强到弱的顺序为Mg>Fe>Cu.
故填:Fe+CuSO4═FeSO4+Cu;Mg>Fe>Cu.
(2)将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,说明②中的硫酸铜过量,和①中的铁反应生成了铜,一段时间后过滤,滤渣中一定含有的物质是铜,可能有的物质是铁.
故填:铜;铁.
方案如下表所示:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加稀盐酸 | 没有气泡产生 | 滤渣中不含有铁 |
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:实验探究题
 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答| 温度℃ | 0 | 10 | 20 | T2 | 40 | 50 |
| 溶解度g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,将温度计玻璃球插入水中 | |
| B. | 过滤时,将玻璃棒靠在三层滤纸的一边 | |
| C. | 在“粗盐中难溶性杂质的去除”实验中,将蒸发皿中的溶液直接蒸干 | |
| D. | 分离硝酸钾和氯化钠组成的混合物-利用硝酸钾和氯化钠分解温度不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
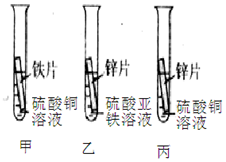 小晨和化学兴趣小组的同学为探究铁、铜、锌的金属活动性顺序,设计了如图三个实验(其中金属均已打磨、其形状、大小及溶液的用量均相同).
小晨和化学兴趣小组的同学为探究铁、铜、锌的金属活动性顺序,设计了如图三个实验(其中金属均已打磨、其形状、大小及溶液的用量均相同).查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
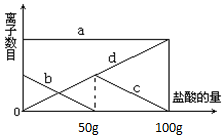 小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应
小明同学在实验室中向25g含有不溶于酸的杂质的碳酸钾配置成溶液,溶液中缓慢地滴加10%的稀盐酸,并不断搅拌,发现开始没产生气泡,盐酸加到一定程度才产生气泡,经查询资料后得知,碳酸钾与盐酸反应先生成碳酸氢钾和氯化钾,随着盐酸的加入,碳酸氢钾再和盐酸反应生成氯化钾释放二氧化碳.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线分别与溶液中的四种离子的对应查看答案和解析>>
科目:初中化学 来源: 题型:解答题
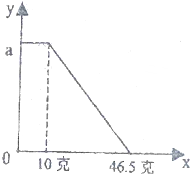 某固体物质由NaOH和MgCl2组成,取一定质量的该混合物溶于水,在所得的悬浊液中逐滴加入溶质质量分数为10%的稀盐酸,发现沉淀的质量(y)与加入盐酸的质量(x)有如图所示的关系,根据此图完成下列问题
某固体物质由NaOH和MgCl2组成,取一定质量的该混合物溶于水,在所得的悬浊液中逐滴加入溶质质量分数为10%的稀盐酸,发现沉淀的质量(y)与加入盐酸的质量(x)有如图所示的关系,根据此图完成下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com