
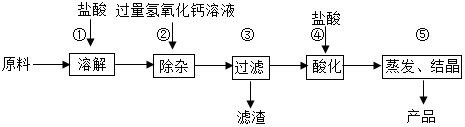
分析 (1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,进行分析解答.
(2)步骤②发生复分解反应生成氢氧化铁,即步骤①中氧化铁与稀盐酸反应生成的氯化铁与氢氧化钙反应生成氢氧化铁沉淀和氯化钙,写出反应的化学方程式即可.
(3)经步骤③过滤后得到的滤液中含有过量的氢氧化钙,结合盐酸具有挥发性,进行分析解答.
解答 解:(1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)步骤②发生复分解反应生成氢氧化铁,即步骤①中氧化铁与稀盐酸反应生成的氯化铁与氢氧化钙反应生成氢氧化铁沉淀和氯化钙,反应的化学方程式为:3Ca(OH)2+2FeCl3═2Fe(OH)3↓+3CaCl2.
(3)经步骤③过滤后得到的滤液中含有过量的氢氧化钙,步骤④加入盐酸的目的是除去过量的氢氧化钙;盐酸具有挥发性,步骤⑤利用盐酸具有挥发性的性质,蒸发除去过量的盐酸.
故答案为:(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;(2)3Ca(OH)2+2FeCl3═2Fe(OH)3↓+3CaCl2;(3)过量的氢氧化钙;易挥发.
点评 本题难度不大,理解以工业碳酸钙为原料生产氯化钙的主要流程,熟练掌握酸的化学性质、盐的化学性质等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | $\frac{a}{b}$ | B. | $\frac{a+b}{2b}$ | C. | $\frac{2a+b}{2b}$ | D. | $\frac{2a}{a+b}$ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
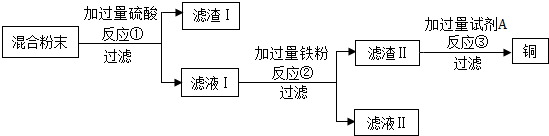
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
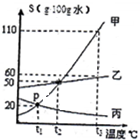 如图是甲、乙、并三种固体物质的溶解度曲线.
如图是甲、乙、并三种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com