
分析 根据溶液中溶质的质量和溶剂质量的计算方法来分析;
根据公式:溶质质量分数=$\frac{溶质质量}{溶液质量}$×100% 一一计算即可.
解答 解:(1)溶质质量=溶液质量×溶质质量分数=80×10%=8g,溶剂质量=溶液质量-溶质质量=80g-8g=72g,故答案为:8;72;
(1)向原溶液中加入40g水,则所得溶液的溶质质量分数为$\frac{8g}{80g+40g}×100%$≈6.7%;故填:6.7%;
(2)向原溶液中加入20g氯化钾固体(固体全部溶解),则所得溶液的溶质质量分数为$\frac{8g+20g}{80g+20g}×100%$=28%;故填:28%;
(3)加水的过程中,溶质的质量不变,所以设加水的质量为x,则
$\frac{8g}{80g+x}×100%=5%$
x=80g
故填:80.
点评 同学们要会根据溶质质量分数=$\frac{溶质质量}{溶液的质量}$×100%灵活计算,要特别注意,溶液质量=溶质质量+溶剂质量.


科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 预期现象与结论 |
| 取小明同学实验中的少量滤液于烧杯中,向烧杯中 加入过量的稀硫酸,并用玻璃棒搅拌. | 有白色沉淀生成,说明含有硫酸根离子,证明矿石中含有碳酸钡 |
| 向上述实验中的上层清液加入足量的碳酸钠溶液 | 有白色沉淀生成,说明含有钙离子,证明矿石中含有碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 项目 | 甲 | 乙 | 丙 |
| 所取固体样品质量(克) | 20 | 10 | 10 |
| 加入AgNO3溶液的质量(克) | 100 | 100 | 200 |
| 反应后所得的沉淀质量(克) | 14.35 | 14.35 | 14.35 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室有瓶标签残缺(如图)的试剂,实孩员告诉小明,这瓶试剂可能是氢氧化钠、氯化钠、硫酸钠、碳酸钠溶液中的一种.为确定试剂成分,小明进行如表实验:
实验室有瓶标签残缺(如图)的试剂,实孩员告诉小明,这瓶试剂可能是氢氧化钠、氯化钠、硫酸钠、碳酸钠溶液中的一种.为确定试剂成分,小明进行如表实验:| 步骤 | 实验操作 | 实验现象 |
| ① | 取5毫升试剂于A试管中,滴入几滴无色酚酞试液 | 无色酚酞试液… |
| ② | 另取5 毫升试剂于B 试管中,滴入几滴氯化钡溶液 | 溶液中出现白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 时间/S | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
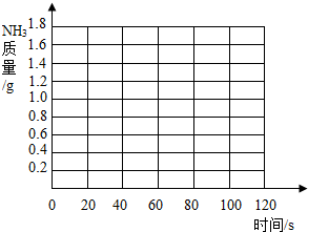
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只含有碳、氢元素基础 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 无法确定 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 硫酸镁溶液可以和氢氧化钠溶液反应
硫酸镁溶液可以和氢氧化钠溶液反应 SO42-
SO42-  Mg2+
Mg2+  Na+
Na+查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 我们在探究物质燃烧的条件时,向在盛有80℃热水的烧杯底部的白磷通入氧气时,奇迹发生了:白磷在水下燃烧起来,写出该化学反应方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.待温度恢复至室温时,向水中滴加紫色石蕊试液,你预测会显红色,写出发生该现象的化学反应方程式P2O5+3H2O=2H3PO4.
我们在探究物质燃烧的条件时,向在盛有80℃热水的烧杯底部的白磷通入氧气时,奇迹发生了:白磷在水下燃烧起来,写出该化学反应方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.待温度恢复至室温时,向水中滴加紫色石蕊试液,你预测会显红色,写出发生该现象的化学反应方程式P2O5+3H2O=2H3PO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com