
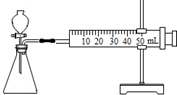
分析 【实验准备】(1)根据配置溶液的操作分析用到的仪器,根据稀释浓硫酸的要求及注意的事项分析;
(2)根据影响反应速率的因素分析需要控制的变量;
【方案一】根据金属与酸反应的剧烈程度比较金属的活泼性;
【方案二】(1)根据检查装置气密性的原理分析;
(2)根据镁与硫酸的反应,写出反应的方程式;
【方案三】根据镁铝与氧气的反应设计实验.
解答 解:【实验准备】(1)用98%的浓硫酸配制l0%的硫酸溶液.除了需要上述仪器外,还 需要用到量筒量取浓硫酸以及水的体积,;在稀释浓硫酸时,一定要把浓硫酸慢慢注入水中,并不断搅拌,且不可将水倒入浓硫酸中;
(2)由于金属体积的大小影响与酸反应的速率.所以,要求两种金属片表面积相同的原因是控制变量;
【方案一】由于镁比铝的活动性强,所以,与硫酸反应时镁比铝反应更剧烈;
【方案二】(1)如果装置不漏气,针筒的活塞被拉出一段后,针筒内压强变小,在大气压的作用下,活塞一段时间后又回到原来的位置;
(2)镁与硫酸反应生成了硫酸镁和氢气,反应的化学方程式是:Mg+H2S04═MgS04十H2↑;要比较两种金属活动性强弱,可以测定两种金属与硫酸反应得到相同体积氢气所需要的时间;还可测定相同时间内产生的气体体积;
【方案三】由于镁、铝的活泼性不同,在空中与氧气的反应不同.所以,比较镁和铝的金属活动性强弱,设计实验是:将镁条、铝条分别在空气中点燃,比较现象.或者镁与铝盐溶液反应等.
故答案为:
【实验准备】(1)量筒 把浓硫酸慢慢注入水中; (2)控制变量;
【方案一】镁比铝的金属活动性强;
【方案二】(1)不漏气; (2)Mg+H2S04═MgS04十H2↑,相同时间内产生的气体体积;
【方案三】将镁条、铝条分别在空气中点燃,比较现象.
点评 本题是一道综合知识题目,考查的角度较广,难度较大,要求学生具有分析和解决问题的能力.


科目:初中化学 来源: 题型:实验探究题
| 序号 | 实验步骤 | 实验现象 | 实验现象 |
| ① | 将该白色固体置于足量蒸馏水中 | 白色固体全部溶解 | 固体可溶于水 |
② | 取少量①所得溶液,向其中滴加酚酞,并振荡. | 溶液变红 | 溶液为碱性 |
③ | 取少量①所得溶液放入试管中,滴加过量,待充 分反应后,滴加数滴无色酚酞试液. | 有白色沉淀生成 溶液变红色 | 该白色固体为氢氧化 钠和碳酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
| 食物 | 苹果 | 葡萄 | 牛奶 | 玉米 |
| PH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
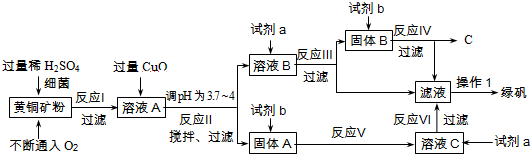
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 | 操作方法 |
| A | CO2 | HCl | 硝酸银溶液 | 通入足量的硝酸银溶液的 洗气瓶后,干燥 |
| B | 碳粉 | 氧化铜 | 一氧化碳 | 通入足量的一氧化碳加热 |
| C | 稀硝酸 | 硫酸 | 氢氧化钡溶液 | 加入适量的氢氧化钡溶液,过滤 |
| D | 氯化钠溶液 | 碳酸钠 | 稀盐酸 | 加入过量的稀盐酸,蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 8g | B. | 18g | C. | 22g | D. | 32g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com