31、Fe(OH)
3是一种红褐色沉淀,Fe(OH)
2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得.由于Fe(OH)
2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)
3,写出其反应的化学方程式:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
,因而在溶液中较难制得纯净的Fe(OH)
2.若按照常规方法向FeCl
2溶液中滴加NaOH溶液,较难观察到白色沉淀现象.
用下面两种精心设计的方法可以制得白色的Fe(OH)
2沉淀.
方法一:用不含氧气的蒸馏水配置FeSO
4溶液与氢氧化钠溶液,然后反应制备.
(1)除去蒸馏水中溶解的氧气,常采用
煮沸
的方法.
(2)先在试管中注入FeSO
4溶液后,还要在试管中滴入
少量植物油
来隔绝空气,然后再考虑加入NaOH溶液,实验更容易获得成功.
(3)生成白色沉淀的操作是用长滴管吸取不含O
2的NaOH溶液,插入FeSO
4溶液液面下,再挤出NaOH溶液,这样操作的理由是
防止氧气进入溶液中
.
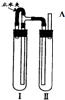
方法二:用如图装置来制备.
(1)在装置Ι中加入Fe和稀H
2SO
4,(2)在装置Ⅱ中加入NaOH浓溶液.
(3)为了制得白色Fe(OH)
2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞,反应一段时间后再夹紧止水夹,在夹紧止水夹之前的实验步骤是
在A处收集氢气进行验纯
,写出夹紧止水夹后Ⅱ中的反应方程式
H2SO4+2NaOH=Na2SO4+2H2O
、
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
.
(4)这样生成的Fe(OH)
2沉淀能较长时间保持白色,其原因是
隔绝了氧气
.




 28、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是
28、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是