
分析 溶液中只有一种阴离子氯离子,所以与铁离子结合时只能是氯离子,所以杂质是氯化铁,根据溶液呈中性,所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等进行分析:设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比.
解答 解:设溶液中的H+个数是91x,则Cl-的个数是94x,再设的Fe3+个数是y,由所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等得:94x=91x+3y,所以,y=x,得出盐酸中Fe3+和Cl-的个数比:1:94.
故答案为:1:94.
点评 解答本题的关键是:利用了在溶液中所有的阳离子所带正电荷总数与所有阴离子所带负电荷总数相等的关系进行求离子的个数比.


科目:初中化学 来源: 题型:解答题
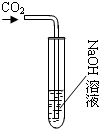 化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.新
化学学习小组的同学们在探究氢氧化钠的性质时,将二氧化碳通入盛有氢氧化钠溶液的大试管中,如图所示,结果同学们没有观察到明显现象,于是他们展开了如下探究.新| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量大试管中的溶液于试管中,加入足量CaCl2溶液,过滤 ②向滤液滴加适量酚酞 | ①产生白色沉淀 ②溶液变红 | 贝贝的猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NO | B. | SO2 | C. | CO | D. | CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验.
科学兴趣小组学习了二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验.| 时间/秒 | 生成氧气的体积/毫升 | |||
| 0.1克MnO2 | 0.2克MnO2 | 0.3克MnO2 | 0.4克MnO2 | |
| 40 | 49 | 61 | 75 | 86 |
| 80 | 77 | 87 | 90 | 92 |
| 120 | 89 | 92 | 92 | 92 |
| 160 | 92 | 92 | 92 | 92 |
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸、酒石酸都不是强酸 | |
| B. | 对人而言,酒石酸是必需的营养品 | |
| C. | MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感 | |
| D. | 酒石酸钠水解显酸性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
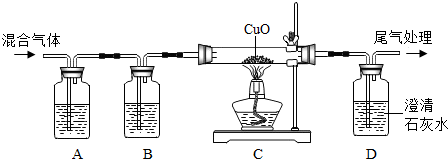
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com