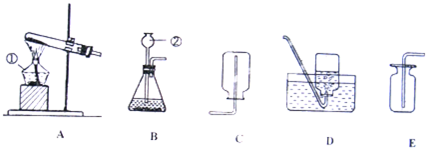
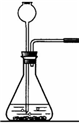
解答:解:(1)①在常温下,实验室常用过氧化氢在二氧化锰的催化作用下分解制取氧气,属于固液常温下反应制取气体,可用发生装置①,由于氧气的密度比空气略大,不易溶于水,可用②或⑥收集氧气;由于分液漏斗可以控制加入液体的量,所以,能改进的制取氧气的装置是①,可以把①中的长颈漏斗改成分液漏斗,控制反应式的速率;
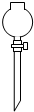
②实验室常见仪器是试管,它可作为少量物质的反应容器.
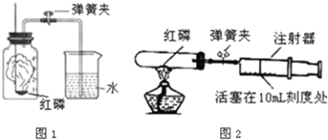
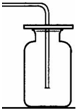
(2)①图中B是集气瓶,集气瓶;
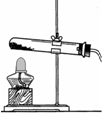
②该装置适合固液不加热反应,我们可以用过氧化氢溶液和固体二氧化锰反应制取氧气,其中二氧化锰在反应前后性质和质量都不发生变化,所以二氧化锰起催化作用.
③氧气的密度大于空气的密度,不易溶于水,所以除用排水法收集外,还可以用向上排空气法收集;
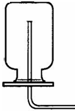
④这种做法可以使装置内外形成压力差,看装置是否漏气;
(3)高锰酸钾受热分解产生了锰酸钾、二氧化锰和氧气,该反应的化学方程式为:2KMnO
4K
2MnO
4+MnO
2+O
2↑;
提出猜想:根据质量守恒定律可知,含有氧元素的物质才有可能生成氧气,则:二氧化锰和锰酸钾或MnO
2和K
2MnO
4中都含有氧元素;
实验验证:通过对二氧化锰加热,质量没有减少,所以可以判断二氧化锰不能分解产生氧气,故猜想1错误;
②根据氧气能够支持燃烧的性质可以知道,可以用带火星的木条复燃,所以可以用带火星的木条来进行检验.
拓展延伸:取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾,用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:要想发现问题,必须细心认真;要想解决问题,必须认真分析问题的原因所在,并用实验去验证.
故答案为:(1)①、①②或⑥;用⑤分液漏斗代替长颈漏斗;②、试管;作为少量物质的反应容器;
(2)①集气瓶;②H
2O
2,催化,③向上排空气法.④检查装置的气密性.
(3)2KMnO
4K
2MnO
4+MnO
2+O
2↑;
提出猜想:它们都含有氧元素;实验验证:①I;②用导出气体的导管口放一支带火星的小木条,观察到小木条复燃,则有O
2生成了;
拓展延伸:为了探究氧化钾对高锰酸钾的分解是否有影响,可以取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
实验反思:要想发现问题,必须细心认真;要想解决问题,必须认真分析问题的原因所在,并用实验去验证.


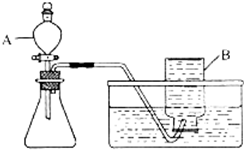 ①甲同学选用如图所示的装置制取氧气.写出仪器B的名称:
①甲同学选用如图所示的装置制取氧气.写出仪器B的名称:

 智能训练练测考系列答案
智能训练练测考系列答案