
| 174 |
| x |
| 233 |
| 6.99g |
| 149 |
| y |
| 233 |
| 6.99g |
| 5.25g |
| 24.01g |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
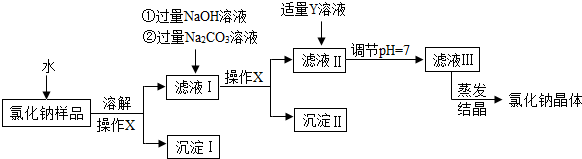
查看答案和解析>>
科目:初中化学 来源: 题型:
 |  |  |  |
| A.向一定量稀盐 酸中加水稀释 | B.一定温度下,向不饱和碳酸钠溶液中加入碳酸钠 | C.加热一定量的 高锰酸钾固体 | D.红磷地密闭容器中燃烧 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | A | B | C | D |
| 反应前质量(g) | 30 | 6 | 8 | 1 |
| 反应后质量(g) | 6 | 21 | m | 10 |
| A、物质C一定是催化剂 |
| B、物质A一定是化合物,物质D可能是单质 |
| C、该反应为化合反应 |
| D、若B和D相对分子质量之比为5:3,则B和D的化学计量数之比是3:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
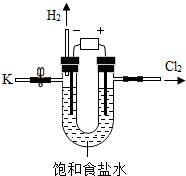 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出一定量的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出一定量的溶液作为待测液进行如下探究.
| ||
| 实验步骤 | 实验现象 | 实验结论 |
| 待测液中含有氢氧化钠. |
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
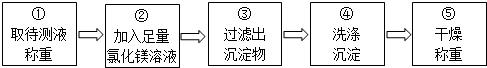
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
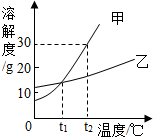 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:
 (1)写出下列化学符号
(1)写出下列化学符号查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com