
下列除去杂质所选用的试剂正确的是
| 选项 | 物质(括号内为杂质) | 去除杂质所选用的试剂 |
| A | NaCl溶液(Na2CO3) | 稀H2SO4 |
| B | FeCl2 (CuCl2) | 镁粉 |
| C | Cu(Zn) | CuSO4 |
| D | CO2 (H2O) | NaOH |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源: 题型:
学习化学一年后,同学们对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑。在老师的帮助下,用金属钠来探究下列问题 :
:
【提出问题】1.金属钠能否置换出硫酸铜溶液中的铜?
2.金属钠能否在其他气体(如:CO2)中燃烧?
【查阅资料】金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠。金属钠还可以与水剧烈反应放出氢气。
【实验探究】
实验一:① 在实验室中,金属钠保存在煤油中;
② 用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③ 按照步骤②将金属钠投入水中,待反应结束后滴加酚 酞溶液,发现溶液变红。
酞溶液,发现溶液变红。
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质。
【问题讨论】
⑴ 金属钠保存在煤油中的原因是: ▲ 。
⑵ 根据上述资料写出钠块投入水中发生反应的化学方程式: ▲ 。钠投入硫酸铜溶液中总的化学反应方程式 ▲ 。氢氧化铜受热分解成氧化铜和水,若将24.0g剩余固体继续高温加热,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式 ▲ 。
⑶ 实验二中生成的黑色颗粒是 ▲ ,而白色物质可能是什么呢?
① 同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是氧化钠,乙认为是碳酸钠,丙认为是 氧化钠和碳酸钠的混合物,丁认为是氢氧化钠。
氧化钠和碳酸钠的混合物,丁认为是氢氧化钠。
我认为丁的猜想是错误的,理由是 ▲ 。
② 对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有氧化钠。
方案2:取该样品少量于试管里,滴加足量盐酸,溶液中有气泡冒出,结论:白色物质中一定有 ▲ 。
方案3:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入过量的 ▲ 溶液(供选试剂:A.石灰水B.氯化钙溶液 C.硫酸铜溶液,填序号),出现白色沉淀,然后过滤,再向溶液里滴加无色酚酞试液,无明显现象出现。则 ▲ (在甲、乙、丙中选)的猜想成立。
③ 评价与反思:小娟同学认为实验方案1得出的结论不正确,其理由是 ▲ ;
实验室中的金属钠着火时,你的灭火方法是 ▲ 。
【拓展应用】测定实验中使用的标有质量分数为16%的盐酸(图1)的实际质量分数。
(1)为了测定,需配制20%的氢氧化钠溶液100g。配制步骤有:①溶解 ②计算,需氢氧化钠 ▲ g ③装瓶并贴标签 ④称取氢氧化钠,量取水 ▲ mL(水的密度为1g/mL)。其正确的顺序为 ▲ (填序号)。
配制氢氧化钠溶液时,需要的玻璃仪器有量筒、烧杯、滴管及 ▲ 。
(2)小明同学在烧杯中加入配得的氢氧化钠溶液20g,再逐滴加入该盐酸。用pH测定仪测定滴加过程中溶液的pH。图2为测定仪打印出的滴加盐酸的质量与溶液pH的关系图。
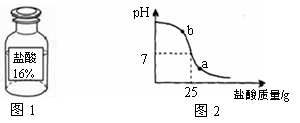 |
①a点对应的溶液呈 ▲ (填“酸性”、“碱性”或“中性”);b点对应的溶液中的溶质为 ▲ (写化学式)。
②请以此次测定的数据,列式计算该盐酸的实际质量分数?(2分)
▲
(3)该盐酸的实际质量分数与标签上标出的质量分数不一致的可 能原因 ▲ (不考虑误差)。
能原因 ▲ (不考虑误差)。
查看答案和解析>>
科目:初中化学 来源: 题型:
某化学反应的微观过程如图所示,则下列说法中,不正确的是( )
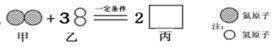
A.该反应中分子和原子的种类都发生了改变 B.物质丙的化学式是NH3
C.甲、乙两物质参加反应的分子个数比为1:3 D.图示反应属于化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
下列关于碳及碳的氧化物的说法不正确的是
A.活性炭可吸附水中的色素 B.用闻气味的方法能够区别CO2和CO
C.CO可以在氧气中燃烧 D.CO2可作为大棚种植农作物的气体肥料
查看答案和解析>>
科目:初中化学 来源: 题型:
下列有关金属的说法正确的是
A.地壳中含量最高的金属元素是铁 B.钢铁严重锈蚀后不值得回收
C.钢的性能优良,所以钢是很纯的铁 D.多数合金的抗腐蚀性比组成它们的纯金属好
查看答案和解析>>
科目:初中化学 来源: 题型:
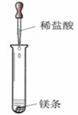 以下是对有关金属与盐酸反应的系列研究。
以下是对有关金属与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化
实验时需将镁条进行打磨,其目的是 。
反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填“吸热”
或“放热”),化学方程式为 。
研究二:用右下图所示装置进行不同金属与盐酸反应的探究
(1)比较金属镁和铁与盐酸反应的剧烈程度,实验条件的要求是 。
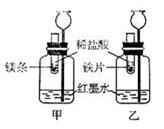 A.反应的温度可以不同 B.镁条和铁片形状、大小相同
A.反应的温度可以不同 B.镁条和铁片形状、大小相同
C.所用稀盐酸的质量分数相同 D.所用稀盐酸的质量相同
(2)观察到甲乙两图中长颈漏斗内液面上升高度不同,由此得出的结论是 。
(3)若实验所用的金属均过量,则甲装置中产生的H2___________(填“多于”、“少于”或“等于”)乙装置中产生的H2质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
甲、乙两同学在学完酸的化学性质后,做了如下实验:
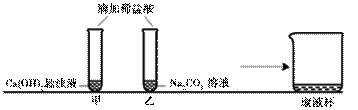 |
【 观察与讨论1】甲同学在做实验时观察到的明显现象是悬浊液由浑浊变
观察与讨论1】甲同学在做实验时观察到的明显现象是悬浊液由浑浊变 澄清 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
澄清 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:
在碳酸钠溶液中逐滴加入少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,才能观察到有气泡产生,再发生反应的化学方程式为  。
。
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。据此可以确定,甲同学的试管中废液含有的溶质一定有酚酞、 (写化学式),
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
【提出问题】最终废液中除酚酞外还含有什么溶质?
【猜想与假设】猜想1:废液中含 有CaCl2、 NaCl两种溶质。
有CaCl2、 NaCl两种溶质。
猜想2:废液中含有 (写化学式)三种溶质。
猜想3:废液中含有NaHCO3、CaCl2、 NaCl三种溶质。
【活动与探究】甲、乙同学为了验证猜想,进行了如下实验:
| 方案 | 方法步骤 | 实验现象 | 实验结论 |
| 甲同学 | 取少量废液于试管中,向其中滴加盐酸, | 无气泡产生 | 猜想3不正确 |
| 乙同学实验 | 取少量废液于试管中,向其中加入 |
| 猜想2正确 |
【表达与交流】甲、乙同学经过实验确认了混合废液中溶质的成分。以下甲乙同学关于废液成分的观点,你赞成的有 。
A.可以加入适量的石灰石或熟石灰对混合废液进行处理后排放
B.取混合废液,滴加少量碳酸钠溶液,则一定能观察到白色沉淀
C.取混合废液,滴加少量硝酸银溶液,则一定能观察到白色沉淀
D.可以用碳酸钠溶液对废液成分中氯化钙的含量进行定量测定
查看答案和解析>>
科目:初中化学 来源: 题型:
化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
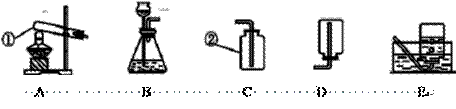 |
(1)写出指定仪器的名称: ② ▲ .
(2)实验室制取CO2的化学反应原理是(写化学方程式) ▲ .
(3)硫化氢(H2S)是一种无色,有臭鸡蛋气味的气体,它的密度比空气大,能溶于水,水溶液叫氢硫酸,硫化氢有剧毒。
①收集硫化氢气体时应选用 ▲  装置(填字母序号);
装置(填字母序号);
②实验室用硫化亚铁与稀盐酸反应制取硫化氢,同时生成氯化亚铁,写出制取硫化氢的化学方程式 ▲ ;
③从环保的角度考虑,制取硫化氢后应采取的措施是 ▲ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com