
分析 (1)根据氯化钠和碳酸钠的物理性质和化学性质回答;
(2)根据塑料的性质来分析;
(3)根据食品中富含的营养素来分析;
(4)鉴别物质时,利用物质之间的性质不同,通过出现两种不同的现象加以区别;
(5)根据蛋白质的食物来源来分析.
解答 解:(1)由于二者味道不同,可用品尝的方法,有咸味的是食盐,有涩味的是纯碱;根据氯化钠与醋酸不反应,碳酸钠能与醋酸反应生成二氧化碳气体,可用醋鉴别,加食醋,有气泡产生的原物质是纯碱,无明显现象的是食盐;故填:品尝,有咸味的是食盐,有涩味的是纯碱;加食醋,有气泡产生的原物质是纯碱,无明显现象的是食盐(其他正确答案也可);
(2)聚氯乙烯受热会产生有毒的氯化氢,所以不能用聚氯乙烯塑料来包装食品;故填:聚氯乙烯;
(3)蔬菜、水果等富含人体所需的维生素;故填:维生素;
(4)蚕丝成分是蛋白质,灼热有烧焦羽毛味,合成纤维燃烧则无此气味;故填:灼烧闻气味,有烧焦羽毛气味的为天然蚕丝;
(5)A.鱼肉中富含蛋白质;
B.牛奶中富含蛋白质;
C.猪油中富含油脂;
D.蔬菜中富含维生素.
故选AB.
点评 化学来源于生产生活,也必须服务于生产生活,所以与人类生产生活相关的化学知识也是重要的中考热点之一.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 20 | 50 | 80 | 30 |
| 反应后质量(g) | 0 | 100 | 20 | x |
| A. | 反应后丁的质量x为30 g | |
| B. | 参加反应的甲、丙的质量比为1:4 | |
| C. | 若乙为单质,丁为化合物,则该反应一定是置换反应 | |
| D. | 若该反应为复分解反应且甲、乙、丙分别为酸、盐、碱,则丁一定是水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
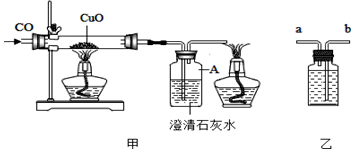
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
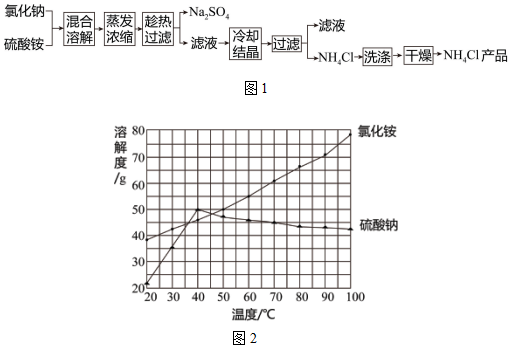
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 物质 | KCl | CaCl2 | KClO3 | Ca(ClO3)2 |
| 溶解度/g | 34.2 | 74.5 | 7.3 | 209.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 浓硫酸(H2SO4)500毫升 | |
| 浓度(质量分数) | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com