
(7分)金属材料在我国建设中起着重要的作用。
(1)钢铁舰身的锈蚀主要是铁与空气中的_______共同作用的结果。
(2)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为 。
(3)回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后
可得到铜和硫酸亚铁溶液,主要流程如下。
已知:CuO + H2SO4 CuSO4 + H2O
Fe + Fe2(SO4) 3 3FeSO4
① 过程Ⅰ中氧化铁发生反应的化学方程式是________。
② 过程Ⅱ充分反应后,还应有的实验操作是_______。
③ 过程Ⅲ加入适量A,发生反应的化学方程式是________。
④ A~F中含铁元素的有 (填序号)。
(1)H2O和O2 (2)3CO + Fe2O3 高温 2Fe + 3CO2
(3)① Fe2O3 + 3H2SO4 Fe2(SO4) 3+ 3H2O ② 过滤
③ Fe + H2SO4 FeSO4 + H2↑ ④ BCDF
解析试题分析:(1)钢铁舰身的锈蚀主要是铁与空气中H2O和O2的共同作用的结果
(2)工业上用一氧化碳和赤铁矿炼铁反应的化学方程式为:3CO + Fe2O3 高温 2Fe + 3CO2
(3)此题是实验型的推断题,可以推断A为过量硫酸,这样溶液B中的溶质为CuSO4、FeSO4、H2SO4,所以C应该为铁,固体D为铁和铜的混合物,
①过程Ⅰ中氧化铁,能与过量的硫酸反应,发生反应的化学方程式是:Fe2O3+3H2SO4Fe2(SO4) 3+ 3H2O
② 过程Ⅱ充分反应后,还应有的实验操作是将固体和液体分离,是过滤操作
③ 过程Ⅲ加入适量硫酸,是将过量的铁反应掉,发生反应的化学方程式是:Fe + H2SO4 FeSO4 + H2↑
④ A~F中含铁元素的有:BCDF
考点:铁生锈的原理,铁的冶炼,实验型的推断题,酸的化学性质


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:初中化学 来源: 题型:问答题
现有①赤铁矿(主要成份是Fe2O3)②磁铁矿(主要成份是Fe304)③黄铁矿(主要成份是FeS2),请你从经济效益和环境保护的角度分析三种矿石哪种不适合用来炼铁?为什么?
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:
【提出问题】猜想Ⅰ:铜与浓硫酸不能反应;
猜想Ⅱ:铜与浓硫酸能反应,且可能生成氢气。
【实验探究】实验Ⅰ:在一支试管中加入一小片铜,再加入少量的浓硫酸,放置一段时间,试管中无现象;
实验Ⅱ:再给上述试管加热,试管中产生有刺激性气味的气体,将反应后的溶液小心地注入到盛有少量水的烧杯中,溶液呈现出明显的蓝色。
【分析猜想】(1)溶液呈蓝色,说明生成了
(2)根据实验现象及已有的知识推断,产生的气体不可能是氢气,很可能是一种含硫元素的气体。
【查阅资料】(1)常见的含硫元素的气体有二氧化硫和硫化氢。
(2)二氧化硫和二氧化碳相似,都能和氢氧化钠等碱溶液反应生成盐和水。
(3)二氧化硫能使品红溶液褪色,加热,又能恢复原来的红色。硫化氢不能使品红溶液褪色。
(4)二氧化硫和硫化氢均有毒。
【实验探究】为了检验产生的有刺激性气味的气体的成分,小红和她的同学进一步实验:将产生的气体通入品红溶液中,品红溶液褪色,加热,溶液又恢复了红色。
【实验结论】(1)在常温下,铜与浓硫酸不能反应。
(2)在加热条件下铜与浓硫酸反应产生的气体是 ,此反应还生成了水,请写出该反应的化学方程式 ;
(3)浓硫酸与铜加热时能反应,而稀硫酸与铜即使加热也不能反应,由此说明:物质的化学性质除了与物质本身的性质有关外,还可能与溶液中溶质的 有关。
【拓展延伸】为了防止污染空气,小红和她的同学采用氢氧化钠溶液来吸收多余的气体,请写出该反应的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上填写对应金属的元素符号。
【作出猜想】猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 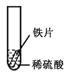 | 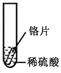 | 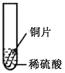 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | |
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
人类生产和生活中都离不开金属。
(1)用铜丝作导线,主要利用其延展性和______性。
(2)铁生锈的条件是 。
(3)某工厂废料中可能含有铜、氧化铜和碳粉中的一种或几种。为确定其成分,设计如下流程并实验。
【资料:CuO + H2SO4 = CuSO4 + H2O】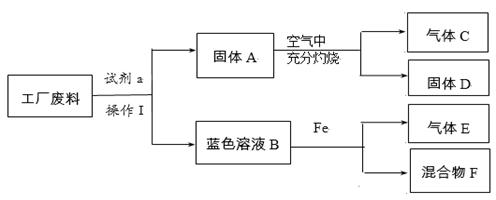
根据流程回答下列问题:
①实验操作Ⅰ的名称是______。
②蓝色溶液B与Fe反应的化学方程式是 。
③废料的成分是
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作b的名称是 ;该操作中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式: ,该反应的基本类型是 。
(4)实验步骤②中除了加入适量的稀硫酸外,还可选用适量的下列试剂 (填标号)。
a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液
查看答案和解析>>
科目:初中化学 来源: 题型:信息分析题
下图为某化工企业生产流程示意图:
下列说法正确的是
| A.钛酸亚铁(FeTiO3)中钛元素为+3价 |
| B.①中反应方程式为:2FeTiO3+6C+7Cl2一定条件2X+2TiCl4+6CO,则X为FeCl3 |
| C.②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 |
| D.③中氩气(Ar)作保护气,反应类型为复分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
为了弘扬中华民族的传统文化,某校在端午节开展了包粽子活动.
(1)老师准备了糯米、鲜猪肉、植物油、调味品等原谅以及粽叶,在各种原料中富含糖类的是 .
(2)粽子吃起来咸淡适中,有同学猜想其中一定含有食盐.于是从煮过粽子的锅里取少量的水于试管中,滴加硝酸银溶液,产生了不溶于稀硝酸的白色沉淀,你认为这样的实验现象能否证明食盐的存在,并说明理由. .
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
许多植物花瓣的浸出液遇到酸性或碱性溶液都会呈现出不同的颜色,在化学实验室中,常用作酸碱指示剂.现提取几中植物花瓣的浸出液分别滴入三种溶液中,实验记录如下表:
| 植物浸出液 | 稀盐酸溶液 | 氯化钠溶液 | 稀氢氧化钠溶液 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 牵牛花 | 红色 | 紫色 | 蓝色 |
| 玫瑰花 | 浅红色 | 浅红色 | 绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com