
分析 化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零.
解答 解:(1)干冰是固体的二氧化碳,其化学式为:CO2.
(2)硝酸亚铁中铁元素显+2价,硝酸根显-1价,其化学式为:Fe(NO3)2.
(3)氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3.
(4)氯酸钾中钾元素显+1价,氯酸根显-1价,其化学式为:KClO3.
故答案为:(1)CO2;(2)Fe(NO3)2;(3)Al2O3;(4)KClO3.
点评 本题难度不大,掌握化合物化学式的书写一般规律(金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零)是正确解答此类题的关键.


科目:初中化学 来源: 题型:实验探究题
| 实验 | 现象 | 解释与结论 |
| 实验1:取直径0.20 mm、含碳0.1% 的铁丝,在氧气中燃烧 | 零星的火星四射 | 铁燃烧的文字表达式是铁+氧气$\stackrel{点燃}{→}$四氧化三铁 0.20.20mm的铁丝在氧气中燃烧,“火星四射”与其含碳量的关系为含碳量越高,火星四射的现象越明显 |
| 实验2:取直径0.20 mm、含碳0.32%的铁丝,在氧气中燃烧 | 较明显的火星四射 | |
| 实验3:取直径0.20 mm、含碳0.52%的铁丝,在氧气中燃烧 | 明显的火星四射 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 工业生产中制取氧气:2KClO3 $\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | |
| B. | 用铁桶盛装波尔多液:Fe+CuSO4═Cu+FeSO4 | |
| C. | 用点燃的方法除去二氧化碳中少量的一氧化碳:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$ 2CO2 | |
| D. | 证明锌是金属活动性顺序表中氢之前的金属:Zn+2HCl═ZnCl2+H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 31:44 | B. | 8:11 | C. | 10:11 | D. | 40:9 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
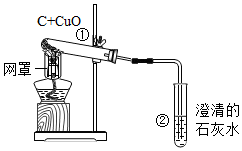 用木炭还原氧化铜的实验如图所示.请回答相关问题:
用木炭还原氧化铜的实验如图所示.请回答相关问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com