
 2CO2+4H2O则由此得出的下列结论,完全正确的一组是( )
2CO2+4H2O则由此得出的下列结论,完全正确的一组是( ) ×100%=2.4克;
×100%=2.4克; 2CO2+4H2O
2CO2+4H2O ,x=7.2克,故氢元素的质量为7.2g×
,x=7.2克,故氢元素的质量为7.2g×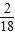 ×100%=0.8克;
×100%=0.8克; ×100%=2.4克,再计算R中碳元素的质量分数为:
×100%=2.4克,再计算R中碳元素的质量分数为: ×100%=37.5%;故②正确
×100%=37.5%;故②正确 2CO2+4H2O
2CO2+4H2O ,x=7.2克,故③6.4gR燃烧还生成了7.2gH2O,正确;
,x=7.2克,故③6.4gR燃烧还生成了7.2gH2O,正确; 2CO2+4H2O
2CO2+4H2O =
=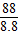 ,解得R的相对分子质量为32.故④R的相对分子质量等于64,错误
,解得R的相对分子质量为32.故④R的相对分子质量等于64,错误

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com