
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中, 加入足量的稀盐酸,塞上带导管的单孔塞,把导管插入另一盛有澄清石灰水的试管中 | 有气体产生, 气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后试管中加少量 品红溶液 | 品红溶液褪色 |
分析 (1)次氯酸分解生成了盐酸,盐酸属于强酸,因此溶液的pH减小;
(2)次氯酸钙能和稀盐酸反应生成氯化钙和次氯酸;
(3)该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;该漂白粉全部变质,固体成分为CaCl2、CaCO3.
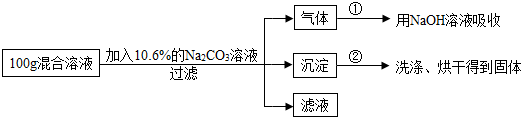
(4)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,和氯化钙反应生成碳酸钙沉淀和氯化钠,根据反应的化学方程式及其提供的数据可以进行相关方面的计算和判断.
解答 解:(1)某瓶HClO溶液放置一段时间后,次氯酸分解生成了盐酸,溶液的酸性增强,pH减小.
故填:减小.
(2)漂白粉中的次氯酸钙和稀盐酸反应生成氯化钙和次氯酸,加入盐酸反应的化学方程式为:Ca(ClO)2+2HCl=CaCl2+2HClO.
故填:Ca(ClO)2+2HCl=CaCl2+2HClO.
(3)【猜 想】
猜想1:该漂白粉未变质,成分不变,因此固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,一部分次氯酸钙和空气中的水、二氧化碳反应生成了碳酸钙,因此固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,全部的次氯酸钙和空气中的水、二氧化碳反应生成了碳酸钙,因此固体成分为CaCl2、CaCO3.
故填:CaCl2、Ca(ClO)2、CaCO3.
【实验探究】实验方案如下表所示:
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入足量的稀盐酸,塞上带导管的单孔塞,把导管插入另一盛有澄清石灰水的试管中 | 有气体产生, 气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后试管中加少量品红溶液 | 品红溶液褪色 |
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | NaCl、NaOH、NaNO3 | B. | NaOH、H2SO4、KNO3 | ||
| C. | HCl、NaCl、Na2SO4 | D. | NaCl、BaSO4、CuSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 实验的步骤为计算、称取、量取、溶解、转移 | |
| B. | 用100ml烧杯量取47.5ml的水 | |
| C. | 将2.5g固体放于托盘天平的右盘称取 | |
| D. | 用蒸馏水洗涤试剂瓶后立即盛装配好的硝酸钾溶液,并贴上标签 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+、Na+、Cl-、HCO3- | B. | H+、K+、Cl-、OH- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Cu2+、Ba2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com