
 ij���������ð�������Ĵ����Ʒ�к��������Ȼ������ʣ����Ʒ��װ����ע����
ij���������ð�������Ĵ����Ʒ�к��������Ȼ������ʣ����Ʒ��װ����ע����| ��������Ĵ��� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
| �ձ�����ʢ����������/g | 181.2 | 204.4 | 228.6 | 253.6 |
���� ��1�����������غ㶨�ɣ��ڻ�ѧ��Ӧ�У��μӷ�Ӧǰ�����ʵ������ܺ͵��ڷ�Ӧ�����ɸ����ʵ������ܺͣ��ʵ�һ�μ���ϡ�����ַ�Ӧ�����ɶ�����̼������=��Ӧǰ�ձ�����ʢ���ʵ������ܺ�-��Ӧ���ձ�����ʢ���ʵ������ܺͣ�
��2����ͼ�����ݿ�֪��ǰ���η�Ӧ��ÿ�������������������1.8g�����Ĵη�Ӧû���������ɣ��ʿ��жϵ����η�Ӧ����ȫ�����������������Ϊ158g+75g-228.6g=4.4g������̼������ϡ���ᷴӦ�Ļ�ѧ����ʽ�����ɵ������������г�����ʽ�����ɼ�������뷴Ӧ��Na2CO3��������Ȼ�����������������=$\frac{��������}{��Һ����}$��100%���㼴�ɣ�
��3�����ڵ�һ�μ�������ʱ������ȫ��Ӧ�����Կ����õ�һ�����ɵĶ�����̼���������Ӧ���Ȼ�����������������������������������
��4�����ݶ�����̼������������ȫ��Ӧʱ����ϡ�����������
��� �⣺��1����һ�εĽ���У�������̼������Ϊ158.0g+100g��4-181.2g=1.8g���ʴ�Ϊ��1.8��
��2��ǰ���η�Ӧ��ÿ�������������������1.8g�����Ĵη�Ӧû���������ɣ��ʿ��жϵ����η�Ӧ����ȫ�����������������Ϊ158g+75g-228.6g=4.4g
����뷴Ӧ��Na2CO3������Ϊx��
Na2CO3+2HCl=2NaCl+CO2��+H2O
106 44
x 4.4g
��$\frac{106}{x}=\frac{44}{4.4g}$��
��֮�ã�x=10.6g��
��Ʒ��̼���Ƶ���������Ϊ��$\frac{10.6g}{11g}$��100%��96.4%��96%��
�ʸò�Ʒ��̼���Ƶ����������ϸ�
��3�����������غ㶨�ɣ���һ�μ��������ַ�Ӧ�����ɶ�����̼������=158.0g+25g-181.2g=1.8g��
������1.8g������̼��Ҫ���Ȼ���������y
Na2CO3+2HCl�T2NaCl+H2O+CO2��
73 44
y 1.8g
$\frac{73}{y}=\frac{44}{1.8g}$
y=$\frac{131.4}{44}$g
��������ϡ���������ʵ���������Ϊ$\frac{\frac{131.4}{44}g}{25g}$��100%��11.9%
��4����̼������ȫ����ʱ�����Ȼ��������Ϊx
Na2CO3+2HCl�T�T2NaCl+H2O+CO2��
73 44
z 4.4g
$\frac{73}{z}=\frac{44}{4.4g}$
z=7.3g��
̼������ȫ����ʱ�������������Ϊ$\frac{7.3g}{11.9%}$=61.3g
��̼������ȫ����ʱ�������������Ϊ61.3g��֮���ټ��������������ɣ�����ʼʱ������Ϊ�㣬������̼ҲΪ�㣮���Ե�ͼ��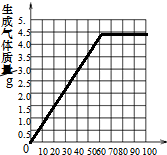
���� ������Ҫ����ѧ�����û�ѧ����ʽ�ۺϷ����ͽ��ʵ�������������������ѧ�����������˼ά��ȣ�ǿ����ѧ������֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ������ˮ���Ӽ������ˮ���ӱ���û�з����仯 | |
| B�� | ���ˮ��ˮ���ӱ���������Ӻ�����ӣ����������⡢��ԭ��δ�����仯 | |
| C�� | Ǧ�����ۺϵõ�������Ǧԭ�Ӻ���ԭ��û�з������ϣ������ǻ���� | |
| D�� | ���Ȼ�������ʳ�Σ���ԭ��ʧ1�����ӣ���ԭ�ӵ�1�����ӣ�Ԫ�ص������ѱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | K2SO4 Ba��OH��2 KCl | B�� | Cu��NO3��2 NaCl KNO3 | ||
| C�� | Na2CO3 KNO3 H2SO4 | D�� | MgSO4 NaNO3 KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ˮ | B�� | ����۷е�� | C�� | �����ȼ�� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
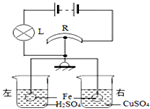 ��ͼ��ʾ��R�ǻ��������������Ľ�����Ƭ��ֱ�̶��ڵȱ۸ܸ˵������ҿ�����ܸ�����ת�����ܸ����˷ֱ����ҵ������������������ʱ�ܸ�ƽ�⣮�ٷֱ�����ͬʱ��û���ܶ���ͬ��ϡ���������ͭ��Һ�У�С������仯���Բ��ƣ�����Ӧһ��ʱ���ɹ۲쵽��������
��ͼ��ʾ��R�ǻ��������������Ľ�����Ƭ��ֱ�̶��ڵȱ۸ܸ˵������ҿ�����ܸ�����ת�����ܸ����˷ֱ����ҵ������������������ʱ�ܸ�ƽ�⣮�ٷֱ�����ͬʱ��û���ܶ���ͬ��ϡ���������ͭ��Һ�У�С������仯���Բ��ƣ�����Ӧһ��ʱ���ɹ۲쵽��������| A�� | �ұ��ձ������������һ���ɫ�������ţ�������������С | |
| B�� | ������Ƭ����ƫת�������·��R��ֵ��� | |
| C�� | ����L�ȿ�ʼʱ�䰵����·�ܹ��ʱ�С | |
| D�� | ����ձ���Һ������������Ҳ��ձ���Һ����������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ��̽����
 ��ͼ�ǻ�ѧ�С���������װ�ã���������;��
��ͼ�ǻ�ѧ�С���������װ�ã���������;���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
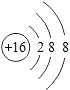 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com