

分析 根据铜绿和稀硫酸反应生成硫酸铜和水还有二氧化碳,过滤的基本操作步骤解答;氧化铁和稀硫酸反应生成硫酸铁和水分析解答;根据二氧化硫有毒和化学反应后原子的种类、数目不改变和冷却饱和溶液结晶的操作解答.
解答 解:(1)碱式碳酸铜的俗称铜绿,能与硫酸反应生成硫酸铜、水和二氧化碳,操作①是过滤,故答案:二氧化碳;过滤;
(2)铜绿和稀硫酸反应生成硫酸铜和水还有二氧化碳,氧化铁和稀硫酸反应生成硫酸铁和水,硫酸过量,故溶质至少含有3种,故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;3;
(3)方法Ⅰ中产生二氧化硫,二氧化硫是有毒气体会污染空气;方法Ⅱ通入空气是铜、稀硫酸和氧气反应生成硫酸铜和水,方法Ⅱ环保;故答案为:环保;
(4)冷却饱和溶液得到硫酸铜晶体先浓缩得到饱和溶液再冷却饱和溶液即可;故答案为:蒸发浓缩、降温结晶.
点评 本题考查了常见的物质的性质,完成此题,可以依据已有的知识进行.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
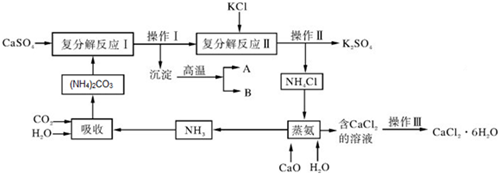
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
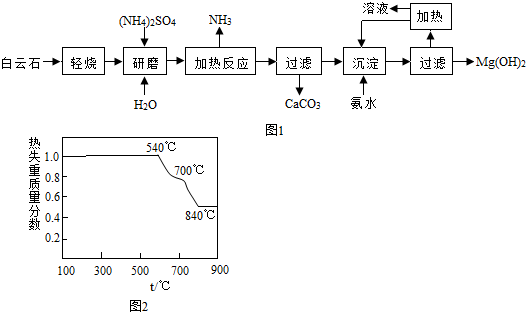
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

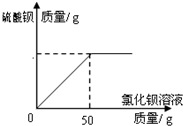 (6)现实验探究产品中硫酸钾的质量分数,取该样品10g配成溶液.滴入稍过量的质量分数为20.8%氯化钡溶液充分反应,得到的数据如下图,求样品中硫酸钾的质量分数?
(6)现实验探究产品中硫酸钾的质量分数,取该样品10g配成溶液.滴入稍过量的质量分数为20.8%氯化钡溶液充分反应,得到的数据如下图,求样品中硫酸钾的质量分数?查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
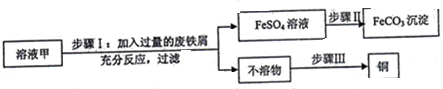
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
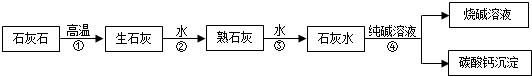
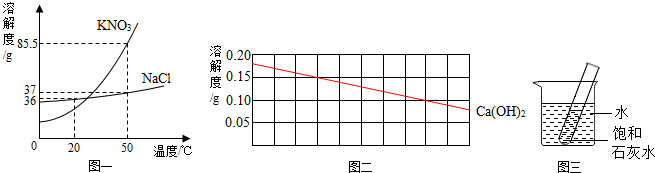
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 测一木块长度时,为减小误差可多次测量取平均值 | |
| B. | 检验碳酸根离子:将要检验的物质与稀盐酸混合,观察是否产生气泡 | |
| C. | 验证质量守恒定律:将锌粒与细流散混合,比较混合前后溶液的质量 | |
| D. | 鉴别H2、CH4、CO三种气体:分别将燃着的木条伸入集气瓶内,观察现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com