
| A. | KNO3 | B. | NH4H2PO4 | C. | NH4HCO3 | D. | KH2PO4 |
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 学习化学后,同学们对课本上“在金属的活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物的溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:
学习化学后,同学们对课本上“在金属的活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物的溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①③④ | C. | ②⑤⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
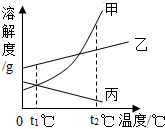 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.现有t2℃时甲、乙、丙三种物质的饱和溶液(无固体存在). 下列说法正确的是( )| A. | 三种物质的溶解度都随温度的升高而增大 | |
| B. | t2℃时三种物质溶解度大小为:乙>丙>甲 | |
| C. | 将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>甲>丙 | |
| D. | 将温度由t2℃降到t1℃时,析出甲的质量比乙多 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +5 | D. | +6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com