
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
| A |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2012年北京市顺义区中考二模化学试卷(带解析) 题型:探究题
二氧化硫是形成酸雨的罪魁祸首之一。化学小组的同学想对二氧化硫进行研究,依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
提出问题:对于制得的气体,有同学认为可能含有杂质。
猜想与假设:化学小组制得的SO2中混有的杂质主要是H2。产生这一结果的主要原因是 (用化学方程式和必要的文字说明)。
查阅资料:(1)CO2能与水、 反应,SO2与CO2一样,也能。
(2)H2与CO一样,能将金属氧化物冶炼成金属。
(3)CaSO3难溶于水
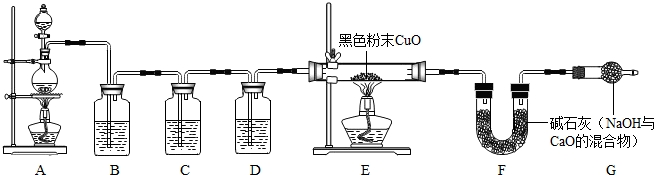
实验验证:为证实相关分析,化学小组的同学设计了下图所示装置进行实验。 
(1)B装置的作用是 。
(2)混合气体中含有氢气,则E装置中观察到的现象是 ,反应的化学方程式为 。
实验反思:小芳认为,利用上述装置可以测定混合气体中二氧化硫和氢气的质量比,要达到这一目的,实验小组必须测定下列数据中的 (填字母)。
| A.参加反应的锌的质量 | B.装置B的质量增量 |
| C.氧化铜的质量 | D.装置 F的质量增量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
查看答案和解析>>
科目:初中化学 来源:2012年北京市顺义区中考化学二模试卷(解析版) 题型:解答题
 浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
浓ZnSO4+SO2↑+2H2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
查看答案和解析>>
科目:初中化学 来源:2012年北京市顺义区中考二模化学试卷(解析版) 题型:探究题
二氧化硫是形成酸雨的罪魁祸首之一。化学小组的同学想对二氧化硫进行研究,依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
ZnSO4+SO2↑+2H2O计算后。取一定量的锌粉与98%的浓硫酸恰好完全反应。
提出问题:对于制得的气体,有同学认为可能含有杂质。
猜想与假设:化学小组制得的SO2中混有的杂质主要是H2。产生这一结果的主要原因是 (用化学方程式和必要的文字说明)。
查阅资料:(1)CO2能与水、 反应,SO2与CO2一样,也能。
(2)H2与CO一样,能将金属氧化物冶炼成金属。
(3)CaSO3难溶于水
实验验证:为证实相关分析,化学小组的同学设计了下图所示装置进行实验。

(1)B装置的作用是 。
(2)混合气体中含有氢气,则E装置中观察到的现象是 ,反应的化学方程式为 。
实验反思:小芳认为,利用上述装置可以测定混合气体中二氧化硫和氢气的质量比,要达到这一目的,实验小组必须测定下列数据中的 (填字母)。
A.参加反应的锌的质量 B.装置B的质量增量
C.氧化铜的质量 D.装置 F的质量增量
【解析】根据题目给出的信息可知:随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2,因此化学小组所制得的气体中混有的主要杂质气体可能是氢气;A是制取气体的装置,B是吸收二氧化硫的装置,可以用氢氧化钠等碱液吸收;C是检验二氧化硫是否除尽的装置,D是浓硫酸,吸水干燥作用;E是用还原性气体还原氧化铜的装置,F中盛放的是无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验.进行解答
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com