将80g硫酸钠和硫酸铁的固体混合物(其中硫酸铁的质量分数为90%),加入358.52g氢氧化钠溶液中,两者恰好完全反应,生成38.52g红褐色沉淀.计算:
(1)此混合物中硫酸铁为多少克?
(2)铁的相对原子质量.
(3)反应后溶液的溶质质量分数.(答案精确到小数点后两位)
【答案】
分析:固体混合物中硫酸铁与氢氧化钠反应硫酸钠同时生成氢氧化铁红褐色沉淀;而硫酸钠与氢氧化钠不反应,最终所得溶液为硫酸钠溶液,溶液中硫酸钠由混合物中的硫酸钠和反应生成的硫酸钠两部分组成部分;因此可根据生成氢氧化铁红褐色沉淀的质量,利用反应的化学方程式,计算出混合物中硫酸铁的质量和生成硫酸钠的质量,即可解决问题.
解答:解:设混合物中硫酸铁的质量为x,生成硫酸钠的质量为y
Fe
2(SO
4)
3+6NaOH═2Fe(OH)
3↓+Na
2SO
4
400 214 142
x 38.52g y
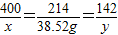
x=72g y=25.56g
反应后溶液的溶质质量分数为
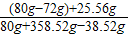
×100%=8.39%
(1)混合物中硫酸铁为72g
(2)反应完毕所得溶液的溶质质量分数是8.39%
点评:根据质量守恒定律,反应后溶液的质量=固体混合物的质量+氢氧化钠溶液的质量-生成沉淀的质量.

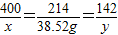
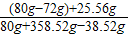 ×100%=8.39%
×100%=8.39%

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案