
【题目】某实验小组为探究酸的化学性质,由甲、乙、丙同学设计并完成了如图所示的实验。

[在阅资料] CaCl2、NaCl 的溶液是中性,Na2CO3溶液显碱性。
[实验探究一]确定甲、乙同学上述实验后所得溶液中的溶质。
(1)取甲所得溶液少许,加入石蕊试液,溶液显红色,甲所得溶液中一定含有的溶质是__(写化学式)
(2)取乙所得溶液少许,加入酚酞试液,溶液显红色,乙所得溶液中一定含有的溶质是___。(写化学式)
[实验探究二]确定甲、乙同学上述实验所得溶液混合后的成分。
(3)甲、乙同学把上述实验所得溶液倒入同一废液缸中,观察到先有气泡产生,后有白色沉淀生成。该白色沉淀是____(写化学式)。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究.
[提出猜想]
(4)甲同学猜想: NaCl
乙同学猜想: NaCl、CaCl2;
丙同学猜想: NaCl、CaCl2、 HCl ;
你的猜想:______。
[交流讨论]
(5)你认为___同学的猜想一定不正确,理由是______。
[设计实验]
(6)请设计实验证明你的猜想正确。
实验现象 | 实验结论 | 实验步骤 |
取少量滤液于试管中,向其中滴加_____ | ______ | 猜想成立。 |
【答案】CaCl2、HCl NaCl、Na2CO3 CaCO3 NaCl、Na2CO3 丙 有盐酸就不会有白色沉淀 氯化钙溶液 有白色沉淀生成
【解析】
(1)氢氧化钙与盐酸反应生成氯化钙和水,取甲所得溶液少许,加入石蕊试液,溶液显红色,说明溶液呈酸性,盐酸过量,甲所得溶液中一定含有的溶质是氯化钙、氯化氢;化学式为:CaCl2、HCl;
(2)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,取乙所得溶液少许,加入酚酞试液,溶液显红色,说明溶液呈碱性,碳酸钠溶液过量,乙所得溶液中一定含有的溶质是氯化钠和碳酸钠;化学式为:NaCl、Na2CO3;
(3)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠。碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,甲、乙同学把上述实验所得溶液倒入同一废液缸中,碳酸钠先与盐酸反应,等盐酸完全消耗后再与氯化钙反应,所以观察到先有气泡产生,后有白色沉淀生成,该白色沉淀是碳酸钙,化学式为:CaCO3;
(4)甲同学猜想NaCl;乙同学猜想:NaCl、CaCl2;丙同学猜想:NaCl、CaCl2、HCl;根据(3)分析可知,当碳酸钠过量,溶液中溶质的成分是NaCl、Na2CO3;
(5)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,丙同学的猜想一定不正确,理由是有盐酸就不会有白色沉淀;
(6)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠。检验碳酸钠溶液存在可用氯化钙溶液。实验证明我的猜想:取少量滤液于试管中,向其中滴加氯化钙溶液,有白色沉淀生成,猜想成立。


科目:初中化学 来源: 题型:
【题目】某学习小组围绕“气体实验室制取”进行了研讨。请你参与完成下面的问题。

(1)实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图_____发生装置(填序号)。
(2)收集装置:实验室收集NH3(极易溶于水)应采用的方法是_____。
(3)收集有毒气体SO2时,常采用③收集装置,气体应从_____(填字母)通入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究。请你参与探究并回答问题。
(提出猜想)假设l:红色粉末是铜粉; 假设2:红色粉末是氧化铁粉; 假设3:红色粉末是____。
(实验探究)某同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按下图装置在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:

反应前 | 反应后 | |
Ⅰ组 | 玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
Ⅱ组 | 洗气瓶和所盛溶液的总质量为180.0 g | 洗气瓶和瓶中物质的总质量为183.1 g |
(交流讨论)
(1)应该选择___________组的实验数据来计算确定组成.最终计算结果表明:该红色粉末的组成是假设____(填序号)成立。
(2)写出A装置中发生反应的化学方程式________________________;实验中观察到A装置中的现象为____________________。
(3)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?请判断并说明理由:________________________________。
(反思评价)
(1)从环保角度,该装置有严重不足之处。你认为应该如何改进?____________________。
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是_________________________。
(3)工业上用2000t含氧化铁75%的赤铁矿,可炼出含铁97%的生铁_________________吨?(结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】自然资源部2020年3月26日公布:我国可燃冰试采创下两项世界纪录。可燃冰是由天然气与水在高压低温条件下形成的类冰状的结晶物质(主要成分化学式CH4·nH2O) 。
(1)计算组成CH4的碳氢元素质量比_____。
(2)下列关于可燃冰的主要成分(CH4·nH2O)中各元素的质量分数,结论正确的是___。(填序号)
A 碳元素的质量分数最大 B 氢元素的质量分数最大
C 氧元素的质量分数最大 D 各元素质量分数的大小关系无法确定
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的转化关系如图所示,“→”表示反应可以一步实现(部分物质和反应条件已省略),下面选项中不能按图示转化关系实现的是
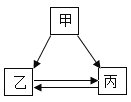
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2O | H2 |
B | NaOH | NaCl | NaNO3 |
C | C | CO2 | CO |
D | Ca (OH) 2 | CaCl2 | CaCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有10g49%稀硫酸的烧杯中加入5.6克的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。下列说法正确的是( )

A. 取a点是溶液,加入锌粉,有气体放出
B. b点时,溶液中溶质只有一种
C. c点时,烧杯中固体一定是铜
D. m=12.7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取10.0g碳酸钙高温加热,一段时间后停止加热,剩余固体中钙元素质量分数为50.0%.下列判断正确的是( )
A. 生成2.0g CO2气体
B. 剩余固体的质量为5.0g
C. 生成了5.6g CaO
D. 剩余CaCO3的质量为8.0g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钢铁在生产、生活中有广泛的用途。请回答:
![]() 炼铁厂常以焦炭、赤铁矿石
炼铁厂常以焦炭、赤铁矿石![]() 主要成分是
主要成分是![]() 、空气等为主要原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:______。
、空气等为主要原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:______。
![]() 每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的______和______共同作用的结果;
每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的______和______共同作用的结果;
![]() 为了防止钢铁锈蚀,人们常采用______的方法
为了防止钢铁锈蚀,人们常采用______的方法![]() 任写一种
任写一种![]() 来达到目的。
来达到目的。
![]() 铁锈的主要成分
铁锈的主要成分![]() ,用盐酸可以除去铁锈。写出盐酸除铁锈的化学方程式:______。
,用盐酸可以除去铁锈。写出盐酸除铁锈的化学方程式:______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室利用下列装置进行实验。

回答问题:
(1)标号①的名称为_____________。
(2)高锰酸钾制氧气的化学方程式为_______,选择的发生装置是_____ (填字母序号),可用D装置收集氧气的理由是____。
(3)实验室制取氢气可采用B或C,选用C装置相对于B装置的优点是______为确保安全,点燃氢气前应进行的操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com