
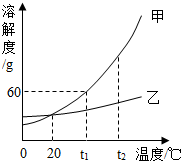
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g | KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | 39.8 | |
分析 (1)根据KNO3和NaCl在不同温度下的溶解度分析回答;
(2)根据不饱和的溶液和饱和溶液之间的转化分析回答;
(3)根据40℃时,KNO3的溶解度计算分析;
(4)根据溶解度的意义计算、分析判断.
解答 解:(1)40℃时,NaCl的溶解度是36.6g,从表中数据可以看出影响物质溶解度的因素是温度;
(2)20℃时,将KNO3不饱和的溶液,转化成该温度下的饱和溶液的一种方法是继续加KNO3至不再溶解;
(3)由表中的数据可知,在40℃时KNO3溶解度是63.9g,所形成的饱和溶液的质量分数是:$\frac{63.9g}{100g+63.9g}×100%$≈39%,所以不能配制出63.9%的溶液.
(4)由于在60℃时,KNO3的溶解度是110g,NaCl的溶解度是37.3g,在0℃时,KNO3的溶解度是13.3g,NaCl的溶解度是35.7g所以,60℃时,把113.3g KNO3和20g NaCl全部放入100g水中,充分溶解后形成KNO3和NaCl的不饱和溶液,溶液中NaCl的质量是20g,0℃时,溶液中NaCl的质量是20g,析出KNO3的质量是100g.由此得出从KNO3和NaCl的混合溶液中KNO3提纯的方法是降温结晶.
故答为:(1)36.6g,温度;(2)继续加KNO3至不再溶解;(3)不能;(4)20,100,降温结晶.
点评 此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,同时也复习了有关混合物分离的一些常识性的基础知识.


科目:初中化学 来源: 题型:解答题
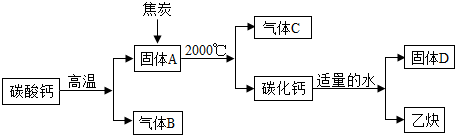
| 反应前质量/g | 反应后质量/g | |
| 装置① | 125.3 | 127.1 |
| 装置② | 78.2 | 87.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 人类的日常生活和工农业生产离不开水.请回答:
人类的日常生活和工农业生产离不开水.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铝、铁、铜都是银白色 | B. | 沙漠地区的铁制品锈蚀较快 | ||
| C. | 铝土矿的主要成分是Al2O3 | D. | 生铁是纯金属,钢是铁的合金 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 剧烈燃烧、发出耀眼白光的是铁 | |
| B. | 产生蓝紫色火焰的是硫 | |
| C. | 有能使澄清石灰水变浑浊的白色气体产生的是木炭 | |
| D. | 有白色且有刺激性气味气体生成的是红磷 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com