
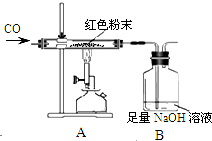
 某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
某化学兴趣小组对一包干燥的红色粉末组成进行探究,同学们根据该红色粉末的来源,判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.| 反应前 | 反应后 | |
| Ⅰ组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
分析 由题目给出的信息可知:取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液;则猜想①一定不成立,因为铜与盐酸不反应;小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到铁丝表面有红色物质生成,得出猜想③成立;在装置A中先通CO气体的目的是:排尽玻璃管内空气;根据上述表格中的实验数据计算:氧元素的质量=48.3g-47.1g=1.2g,氧化铁的质量=1.2g÷$\frac{48}{160}$=4g;红色粉末中氧化铁的质量分数=$\frac{4g}{5g}$×100%=80%;本装置的不足之处是:没有尾气处理装置,改进方法是:在B装置的导管口点燃一氧化碳或扎一个气球.
解答 解:【设计实验】(1)取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液;则猜想①一定不成立,因为铜与盐酸不反应;故填:①;
(2)小伟向小玲得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到铁丝表面有红色物质生成,得出猜想③成立;故填:铁丝表面有一层红色物质析出
;
【交流讨论】
(1)在装置A中先通CO气体的目的是 排出玻璃管内的空气,B装置的作用是 吸收反应产生的CO2.一氧化碳能与氧化铁高温反应生成铁和二氧化碳,故填:排尽空气,防止爆炸;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)因为实验结束后是持续通入一氧化碳知道玻璃管冷却,故不需要先断开装置中A和B的连接处,故填:不需要;实验中持续通入一氧化碳气体直到玻璃管内物质冷却;
(3)从环保角度看上述装置有严重不足之处是:没有尾气处理装置,改进方法是:在B装置的导管口点燃一氧化碳或扎一个气球;故填:缺少尾气处理装置;
(4)根据上述表格中的实验数据计算:氧元素的质量=48.3g-47.1g=1.2g,氧化铁的质量=1.2g÷$\frac{48}{160}$=4g;红色粉末中氧化铁的质量分数=$\frac{4g}{5g}$×100%=80%;故填:80%.
点评 实验探究题是近几年中考的重点内容之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过查阅资料和实验分析,得到了正确的结论,属于结论性探究,有关的计算要准确.同学们要具体分析,综合掌握,本考点主要出现在实验题中.


 综合自测系列答案
综合自测系列答案科目:初中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ①②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | A | B | C | D |
| 反应前质量/g | 19.7 | 8.7 | 21.6 | 0.4 |
| 反应后质量/g | 待测 | 17.4 | 0 | 3.6 |
| A. | 物质C一定是化合物,物质D可能是单质 | |
| B. | 反应后密闭容器中A的质量为19.7g | |
| C. | 反应过程中,物质B和物质D变化的质量比为87:36 | |
| D. | 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 |
| ①取少量上层料液,滴加稀盐酸 | 无明显现象 |
| ②另取少量上层料液,滴加碳酸钠溶液 | 产生白色沉淀 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com