


科目:初中化学 来源: 题型:
| Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(福建福州卷)化学(解析版) 题型:探究题
四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,去氧化物沉淀的pH范围如表。
|
|
Zn(OH)2 |
Fe(OH)2 |
Mg(OH)2 |
|
开始沉淀的pH |
5.7 |
7.6 |
10.4 |
|
沉淀完全的pH |
8.0 |
9.6 |
12.4 |
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
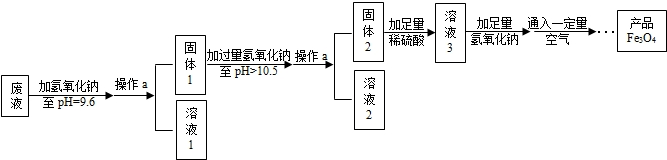
(3)制备Fe3O4的实验流程如下:
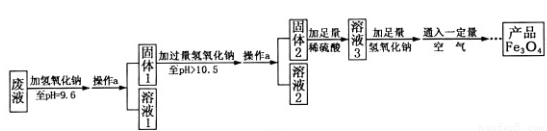
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为 (写一个即可)。
(2)操作a的名称为 。该操作需要的玻璃仪器有烧杯、玻璃棒、 等。玻璃棒在此操作中的主要作用是 。
(3)溶液1所含溶质有 (至少写两种);溶液3所含溶质的主要成分为 。
(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于 (精确到0.01%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
四氧化三铁可用于医疗器械、电子等工业。某实验兴趣小组从工厂采集废液(含FeSO4和少量ZnSO4、MgSO4),进行四氧化三铁的制备实验。
【阅读资料】
(1)25℃时,去氧化物沉淀的pH范围如表3。
| Zn(OH)2 | Fe(OH)2 | Mg(OH)2 | |
| 开始沉淀的pH | 5.7 | 7.6 | 10.4 |
| 沉淀完全的pH | 8.0 | 9.6 | 12.4 |
表3
(2)25℃时,Zn(OH)2可溶于pH>10.5的碱溶液。
(3)制备Fe3O4的实验流程如下:
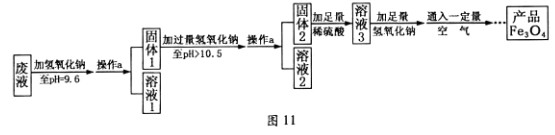
【回答问题】
(1)往废液中加入氢氧化钠溶液生成沉淀的化学方程式为 (写一个即可)。
(2)操作a的名称为 。该操作需要的玻璃仪器有烧杯、玻璃棒、 等。玻璃棒在此操作中的主要作用是 。
(3)溶液1所含溶质有 (至少写两种);溶液3所含溶质的主要成分为 。
(4)该实验取废液100g,最终得到产品四氧化三铁质量为3.48g,则原废液中硫酸亚铁溶质的质量分数不低于 (精确到0.01%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com