
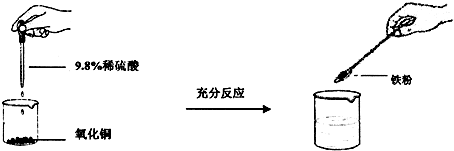
| 学生甲 | 学生乙 | 学生丙 | |
| 氧化铜的质量(g) | 8 | 8 | 8 |
| 9.8%稀硫酸的质量(g) | 50 | 100 | 150 |
| 铁粉的质量(g) | 5.6 | 5.6 | 5.6 |
| 加入铁粉后的现象 | 有红色和黑色固体 | 有红色固体 | 有红色固体 |


科目:初中化学 来源: 题型:
(2011?香坊区二模)除去下列各组物质中的杂质(括号内的物质为杂质,所选试剂均足量),所选用的试剂及操作方法均正确的是( )
|
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 102 |
| 294 |
| x |
| 29.4g |
| 102 |
| 294 |
| x |
| 29.4g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com