2005年10月5日,瑞典皇家科学院将本年度诺贝尔化学奖授予法国化学家伊夫?肖万、美国化学家罗伯特?格拉布和理查德?施罗克,以表彰他们在烯烃复分解反应研究领域作出的贡献.烯烃复分解反应是有机化学中最重要也是最有用的反应之一,烯烃复分解反应已被广泛应用在化学工业,尤其是制药业和塑料工业从中受益无穷.
早在1970年,法国化学家伊夫?肖万就已经详细地从理论上解释了烯烃复分解反应是如何进行的,并且列举了促进这种反应的催化剂的物质成分.1990年,肖万的理论第一次被理查德?施罗克应用在实践中并制造出效果优良的催化剂,两年后,罗伯特?格拉布又发展了施罗克的成果,制造出在空气中更稳定的催化剂.
在颁奖仪式上,评委会主席佩尔?阿尔伯格将烯烃复分解反应描述为“交换舞伴的舞蹈”.他亲自走出讲台,邀请身边的皇家科学院教授和两位女工作人员一起在会场中央为大家表演烯烃复分解反应的含义.最初两位男士是一对舞伴,两位女士是一对舞伴,在“加催化剂”的喊声中,他们交叉换位,转换为两对男女舞伴,在场记者随即发出了笑声.
(1).催化剂在化工生产过程中有着重要作用,有的反应如果没有催化剂就不能进行,大多数化工生产都有催化剂的参与.CuSO
4溶液对过氧化氢的分解具有催化作用.有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究.
①请你帮助他们完成实验报告:
| 实验过程 |
实验现象 |
实验结论 |
| 在一支试管中加入5mL5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管. |
试管中有大量的气泡产生,带火星的木条复燃 试管中有大量的气泡产生,带火星的木条复燃 |
FeCl3溶液可以催化分解H2O2 |
②已知FeCl
3在水中可解离出Fe
3+和Cl
-,同学们提出以下猜想:
甲同学的猜想是:真正催化分解H
2O
2的是FeCl
3溶液中的H
2O;
乙同学的猜想是:真正催化分解H
2O
2的是FeCl
3溶液中的Fe
3+;
丙同学的猜想是:真正催化分解H
2O
2的是FeCl
3溶液中的Cl
-.
你认为最不可能的是
甲
甲
同学的猜想,理由是
因过氧化氢溶液中自身有水,可见水不是催化剂
因过氧化氢溶液中自身有水,可见水不是催化剂
.
③同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
| 实验过程 |
实验现象 |
结论 |
向盛有5mL5%的H2O2溶液的试管中加入少量
的HCl,并把带火星的木条伸入试管. |
无明显现象 |
起催化作用的不是Cl- 起催化作用的不是Cl- |
向盛有5mL5%的H2O2溶液的试管中加入少量
的Fe(NO3)3溶液 Fe(NO3)3溶液 ,并把带火星的木条伸入试管. |
试管中有大量气泡产生,带火星的木条复燃 试管中有大量气泡产生,带火星的木条复燃 |
起催化作用的是Fe3+ 起催化作用的是Fe3+ |
(2)复分解反应是我们学过的化学基本反应类型之一.
①下列化学反应中,属于复分解反应的是
D
D
A、2H
2+O
22H
2O
B、
2KMnO4K2MnO4+MnO2+O2↑C、
Fe2O3+3CO2Fe+3CO2D、CaCO
3+2HCl=CaCl
2+CO
2+H
20
②科学家将复分解反应描述为“交换舞伴的舞蹈”,并表演了其含义.我们也可以用符号表达式来表示复分解反应,请补全下式:AB+CD→
AD+CB
AD+CB
.
③你想过复分解反应为什么能够发生吗?这是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合.如反应BaCl
2+Na
2SO
4=BaSO
4↓+2NaCl中,实际参加反应的离子是Ba
2+和SO
42-,而Cl
-、Na
+则是“旁观者”,并没有参加反应.请你分析反应Ba(OH)
2+2HNO
3=Ba(NO
3)
2+2H
2O中实际参加反应的离子是
OH-、H+
OH-、H+
.
④请根据你的想象,在图右边的容器中画出体现NaOH溶液和稀HCl反应产物的示意图.
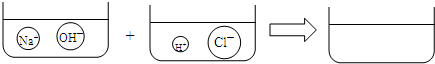
(3)从三位科学家取得成功的事例中,你对科学的发明、发现或创造有什么认识?
科学理论只有同工业结合,创造出改变人类生活、提高生命质量的发明和创造后,才能是有利于人类的科学理论(或科学探究要有合作精神)
科学理论只有同工业结合,创造出改变人类生活、提高生命质量的发明和创造后,才能是有利于人类的科学理论(或科学探究要有合作精神)
.

 ═
═
 ═
═
 ═
═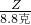
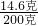 ×100%═7.3%.
×100%═7.3%.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案