
现有一瓶标签已破损的过氧化氢溶液,为测定瓶内溶液中溶质的质量分数,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将杯内剩余物质过滤、洗涤、干燥后得滤渣2g。计算:
(1)生成氧气的质量。
(2)瓶内过氧化氢溶液中溶质的质量分数。
(1)1.6g (2)10%
解析试题分析:化学反应应遵守质量守恒定律,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,有时前后质量看似不相等,是由于反应前有气体参加,或反应后有气体生成没有加进去,这题中二氧化锰在反应充当催化剂,在化学反应中能改变其他物质的反应速率(加快或变慢),但本身的化学性质和质量在反应前后没有发生变化的物质。,所以最后将杯内剩余物质过滤、洗涤、干燥后得滤渣2g,就是二氧化锰的质量,所以反应前的总质量就是=34g+2g=36g,反应后只有34.4g,由质量守恒定律可知,生成氧气质量+36g-34.4g=1.6g,再根据化学反应方程式:2H2O2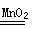 2H2O+ O2↑中过氧化氢的质量与氧气的质量关系,即可算出过氧化氢溶液中溶质的质量,再根据溶质的质量分数的表达式,便可求出结果
2H2O+ O2↑中过氧化氢的质量与氧气的质量关系,即可算出过氧化氢溶液中溶质的质量,再根据溶质的质量分数的表达式,便可求出结果
解:(1)根据质量守恒定律,生成氧气质量为34g-(34.4g-2g)=1.6g
(2)设反应前溶液中含溶质过氧化氢质量为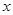
2H2O2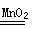 O2↑+2H2O
O2↑+2H2O
68 32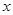 1.6g
1.6g
解得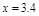 g
g
反应前过氧化氢溶液中溶质质量分数=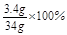 ="10%"
="10%"


科目:初中化学 来源: 题型:计算题
张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反应,也不溶于水)。每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | l0 | l0 | l0 | l0 | l0 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
发射通信卫星的火箭用化学反应2N2H4+N2O4 3X+4H2O为动力来源.
3X+4H2O为动力来源.
(1)上述化学反应中X的化学式是 _________ ;
(2)请计算320g N2H4完全燃烧时消耗N2O4的质量.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
有一研究性学习小组为测定某铜锌合金的成分,取10g该合金经粉碎后放入烧杯中,再加入足量的稀硫酸,反应过程中烧杯内固体物质的质量与反应时间的关系如下图所示。请回答下列问题。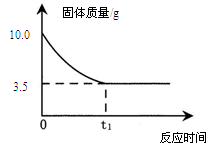
(1)将合金粉碎的目的是 。
(2)10g合金中铜的质量为 g。
(3)充分反应后产生的氢气质量为多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算原过氧化氢溶液中溶质的质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在烧杯里加入6g质量的石灰石和44g质量的稀盐酸,完全反应后烧杯里剩余物质的质量为47.8g,(反应化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2)
(1)根据 定律,生成CO2气体的质量 ;
(2)参加反应的碳酸钙的质量是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化学小组同学欲测定铜锌合金中铜元素的质量分数。
(1)甲方案:取10 g合金粉末,加入少量稀硫酸后,收集到0.1 g氢气,计算合金中铜元素的质量分数为67.5%。老师指出其测定结果不准确,原因是 。
(2)乙方案:取10 g合金粉末,加入足量硫酸铜溶液,充分反应后,过滤,洗涤,烘干,测得固体质量为9.9 g。计算合金中铜元素的质量分数。(写出计算过程
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
碳和碳的氧化物是生活中常见的物质,也是初中化学学习的重要内容.
(1)如图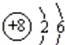 是,下列说法不正确的是 .
是,下列说法不正确的是 .
| A.氧原子的质子数为8 |
| B.氧原子在化学反应中易失去电子 |
| C.氧是地壳中含量最多的元素 |
| D.氧原子与氧离子的化学性质不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
侯氏制碱法的核心反应原理如下:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3
某温度下,向溶质的质量分数为20%的氯化钠溶液47.25g中通入一定量氨气(NH3)和二氧化碳.充分反应后,将溶液中析出的碳酸氢钠晶体过滤,低温烘干,称量,质量为4.4g.计算需要通入氨气的质量.(已知:该温度下碳酸氢钠饱和溶液中,碳酸氢钠与水的质量比为1:9;且溶液中若存在其它溶质,不会对上述比值产生影响).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com