
【题目】利用下图所示装置研究氧气的性质,并测定空气中氧气的含量。
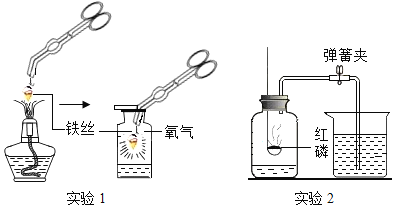
(1)实验 1 中铁丝发生了化学反应,证据是________________。该反应的化学方程式为__________________________。
(2)实验 2 中,点燃红磷前需要用弹簧夹夹紧胶皮管的原因是____________________。
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:初中化学 来源: 题型:
【题目】在过氧化氢溶液的分解反应中,某化学兴趣小组发现:除了二氧化锰,硫酸铜溶液也能对H2O2的分解起催化作用。对此,他们进行了有关探究。
(提出问题)CuSO4溶液是混合物,是其中哪一种成分起到了催化作用呢?
(查阅资料)①稀硫酸中主要含有H2O、H+、SO42三种微粒。
②CuSO4溶液中主要含有H2O、Cu2+、SO42三种微粒。
(作出猜想)根据以上信息,同学们作出了如下三个猜想:
Ⅰ:SO42催化分解H2O2 Ⅱ:Cu2+催化分解H2O2 Ⅲ:H2O催化分解H2O2
(1)其中,明显不合理的是_______(填序号),理由是_______。
(实验验证)
(2)为了验证自己的猜想,同学们设计了如下两个实验(所取H2O2溶液的浓度相同):
操作 | 现象 | 结论 |
取5 mL H2O2溶液于试管中,滴入少量的稀硫酸,伸入带火星的木条 | _______ | SO42对H2O2的分解不起催化作用 |
_______ | 产生大量气泡,带火星的木条复燃 | _______ |
(实验拓展)
实验一:用图甲装置探究影响H2O2分解速率的因素,得到图乙、图丙所示曲线(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计)。
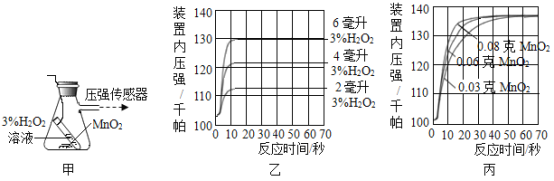
(3)写出图甲中反应的化学方程式_______。
(4)图乙是“0.1 g MnO2与不同体积的3% H2O2溶液混合”的实验结果,从图中可以看出_______。
(5)图丙是用“8 mL浓度为3%的H2O2溶液与不同质量的MnO2混合”时,所得到的曲线,通过该曲线可以得到的结论是_______。
实验二:用图丁装置探究氧气的浓度对燃烧的影响。点燃蜡烛后立即塞紧橡皮塞,待蜡烛熄灭后,将滴管中的水全部滴入瓶中,铝盒中的白磷燃烧。
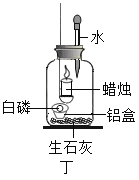
(6)白磷燃烧的主要现象是_______。
(7)由“蜡烛熄灭,白磷燃烧”可得出的结论是_______。
(8)滴入水后白磷燃烧的原因是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
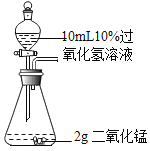
【题目】控制变量设计对比实验是实验探究的重要方法,请参与下列探究并回答问题:
实验一:探究影响过氧化氢溶液分解速率的因素

A B
同时打开A和B装置中分液漏斗的旋塞,根据锥形瓶内产生气泡的速率,得出_________会影响过氧化氢溶液的分解速率,为准确直观比较分解速率的快慢,可测定相同时间内收集到的氧气体积,或者测定_________。
实验二:探究金属与盐溶液的反应
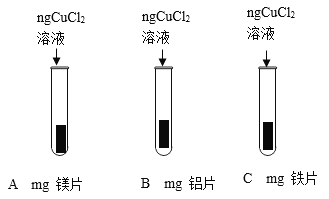
将打磨过的镁片、铝片、铁片分别与氯化铜溶液反应,观察到金属表面都有红色物质生成且镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡产生经查阅资料知氯化铜溶液呈酸性。请写出B试管内发生反应的化学方程式__________________;由此实验______________(填能或否)得出镁铝铁铜四种金属的活动性顺序。
实验三:探究二氧化碳能否与碱溶液反应
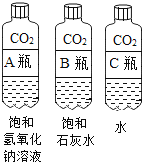
①对比 A 瓶与 B 瓶的实验现象,请说明实验室用氢氧化钠溶液吸收CO2,用石灰水检验二氧化碳的理由_________;
②A瓶与 B瓶的对比,因为 A瓶严重变瘪,说明_________消失,可证明二氧化碳与氢氧化钠溶液发生了反应,也可以通过加入下列物质中的_________证明新物质的生成,从而说明反应的发生。
A 酚酞试液 B 稀盐酸 C Ca(OH)2溶液 D CaCl2溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对酸、碱、盐的部分性质进行探究。
(探究一)氢氧化钠与二氧化碳反应
甲同学设计实验方案如图1所示:

(1)图1中的实验现象为_____________,甲同学由此判断氢氧化钠和二氧化碳发生了反应。
(2)小组内其他同学认为甲同学方案不完善,理由是________________。并对实验进行了改进,改进装置如图2所示:在A处放置适量干冰,B处装入适量的浓NaOH溶液,量筒中加入足量的稀盐酸,实验过程中,观察到量筒中有气泡冒出,原因是______________。一段时间后,观察到的现象是:①量筒中溶液倒吸入B中;②_________________,说明二氧化碳确实与氢氧化钠发生了反应。
(探究二)氢氧化钠和盐酸发生中和反应时放出热量
乙同学向一定量10﹪的氢氧化钠溶液中滴加10﹪的盐酸,滴加过程中温度变化如下表:
加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
混合溶液温度T/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(3)反应的化学方程式为________________。
(4)根据表中数据分析混合溶液温度变化的原因_______________。
(5)小组内其他同学提出“将10﹪的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理并说明理由_______________。
(6)丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象。现将混合液中的氯化钠进行提纯,具体的操作为____________。
(探究三)碳酸钠溶液与稀盐酸的分步反应
(查阅资料)向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应。
丁同学向106g质量分数为10﹪的碳酸钠溶液中逐滴加入质量分数为3.65﹪的稀盐酸,生成二氧化碳的质量变化如图3所示(不考虑CO2的溶解)。
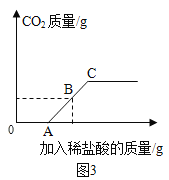
(7)A→Cspan>段发生反应的化学方程式为________________。
(8)若B点横坐标为150,则其纵坐标为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色粉末,可能由 Na2CO3,BaCl2,NaOH,CuSO4 中的一种和几种组成,为了探究固体的成分,现做如下实验:
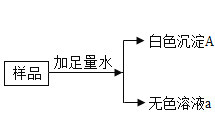

(1)原固体中一定没有_____________;
(2)原固体中一定有____________;
(3)生成气体的化学方程式_____________;
(4)无色溶液a 中一定含有的溶质____________;
(5)下列关于溶液和白色沉淀的设想,合理的是___________。
A除去硝酸钡中的硝酸,加入过量的白色沉淀A
B无色溶液a 能除去氯化钠中少量的盐酸
C鉴别盐酸和碳酸钠:用溶液 b、c、d
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
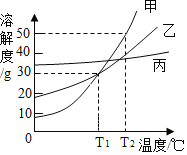
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映对应的实验操作的是
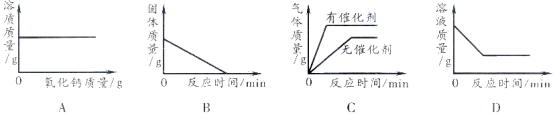
A.向一定量的饱和石灰水中加入氧化钙
B.加热一定量高锰酸钾固体产生氧气
C.用一定量的双氧水制取氧气
D.向一定量的硝酸银溶液中插入铜
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料广泛应用于生产生活中。
(1)常温下大多数金属是固体,但体温计中的金属是液体,该金属是________。用微粒的观点解释利用该金属应于体温的填充剂的原因:___________。
(2)贯休的《读唐史》中“洪炉烹五金,黄金终自奇”从金属的化学性质说明了金的化学性质是__________(填“活泼”或“不活泼”)。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_________(写化学式),试写出其中发生反应的化学方程式____________。
(4)用金属铁制备新型消毒、净水剂K2FeO4的流程图所示:
![]()
①步骤Ⅰ反应的发生反应的基本类型是___________。
②K2FeO4中Fe元素的化合价为_________。
③步骤Ⅱ发生得复分解反应的化学方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com