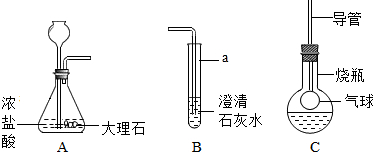
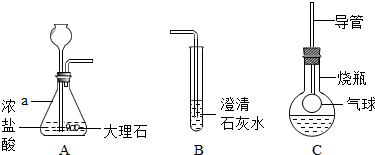
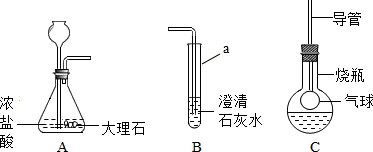
解:(1)试管是常用的反应容器,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可;故答案为:试管;CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
(2)将A中产生的气体通入到B中一会儿,未见其中变浑浊,更简捷的解释是:盐酸和氢氧化钙溶液反应生成氯化钙和水,配平即可;故答案为:2HCl+Ca(OH)
2=CaCl
2+2H
2O
(3)振荡,发现烧瓶中的气球逐渐变大,且溶液始终无色透明,说明二氧化碳与M溶液反应无变化,M溶液是NaOH(或KOH)溶液;故答案为:NaOH(或KOH)
(4)要证明生成物中含有CO
32-,向其中加入BaCl
2溶液或足量的稀盐酸都可,即向其中加入BaCl
2溶液,若生成白色沉淀,即可证明其中含CO
32-;故答案为:向其中加入BaCl
2溶液,若生成白色沉淀,即可证明其中含CO
32-(或:向其中加入过量(或足量)的稀盐酸,若有气泡冒出,则可证明其中含CO
32-(或其他合理表述)
(5)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,配平即可,故答案为:2H
2O
2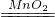
2H
2O+O
2↑
分析:实验室制取CO
2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.将A中产生的气体通入到B中一会儿,未见其中变浑浊,更简捷的解释是:盐酸和氢氧化钙溶液反应生成氯化钙和水,配平即可;振荡,发现烧瓶中的气球逐渐变大,且溶液始终无色透明,说明二氧化碳与M溶液反应无变化,M溶液是NaOH(或KOH)溶液;要证明生成物中含有CO
32-,向其中加入BaCl
2溶液或足量的稀盐酸都可;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,配平即可.
点评:本考点主要考查了二氧化碳和氧气的制法、碳酸根离子的检验,同时也考查了二氧化碳的性质和化学方程式的书写,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


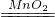 2H2O+O2↑
2H2O+O2↑

 综合自测系列答案
综合自测系列答案