
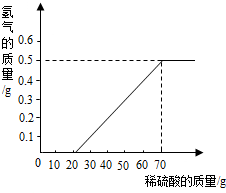
 某兴趣小组用10g存放已久的镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其他杂质)
某兴趣小组用10g存放已久的镁条与溶质质量分数为49%的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其他杂质)分析 (1)根据产生氢气的质量与稀硫酸的质量关系图,读出产生氢气的质量;
(2)镁条的表面有氧化镁能与稀硫酸反应;
(3)根据氧化镁、镁与稀硫酸反应的方程式以及镁之间的关系式求出镁的质量,再计算镁条中镁元素的质量分数.
解答 解:(1)由产生氢气的质量与稀硫酸的质量关系图可知,当稀硫酸的质量为70g,产生的氢气的质量为0.5g;
(2)由于镁易于空气中的氧气反应在镁条的表面生成了氧化镁,稀硫酸首先与镁条表面的氧化镁薄膜发生了反应,所以不产生氢气,反应的方程式是:MgO+H2SO4=MgSO4+H2O.
(3)设镁元素的质量为x
由Mg+H2SO4=MgSO4+H2↑
MgO+H2SO4=MgSO4+H2O
得:H2SO4~MgSO4~Mg
98 24
70g×49% x
$\frac{98}{70g×49%}=\frac{24}{x}$
解得:x=8.4g
镁条中镁元素的质量分数是:$\frac{8.4g}{10g}$×100%=84%
故答案为:(1)0.5;(2)MgO+H2SO4=MgSO4+H2O;(3)84%.
点评 较活泼的金属易于空气中的氧气反应,在金属的表面形成了金属氧化物,当与酸反应时首先金属表面的氧化物与酸反应不能放出氢气.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食品添加剂有害人体健康,应禁止使用 | |
| B. | 购物时减少使用或不用塑料袋,是为了减少“白色污染” | |
| C. | 为防止土壤和水体富营养化,应禁止使用化肥与农药 | |
| D. | 不吃水果蔬菜,多吃含蛋白质的肉类,更能增强体质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 给烧杯加热时,要垫上石棉网 | |
| B. | 给试管里的液体加热,液体体积不超过试管容积的三分之一 | |
| C. | 给试管里的液体加热时,不让试管口对着自己和旁人 | |
| D. | 实验中剩余的药品都要放回原试剂瓶 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
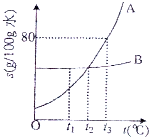 如图表示A、B两种物质溶解度(S)随温度的变化,请回答:
如图表示A、B两种物质溶解度(S)随温度的变化,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
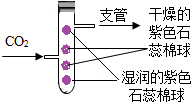 右图是某同学设计,验证二氧化碳性质的装置.通入二氧化碳后,实验现象为两朵干燥的紫色石蕊棉球均不变色,湿润的紫色石蕊棉球,下面那朵先变红,上面那朵后变红.下列推断正确的是 ( )
右图是某同学设计,验证二氧化碳性质的装置.通入二氧化碳后,实验现象为两朵干燥的紫色石蕊棉球均不变色,湿润的紫色石蕊棉球,下面那朵先变红,上面那朵后变红.下列推断正确的是 ( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com