
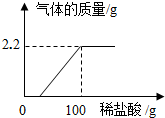
| A. | 呈中性 | B. | 呈酸性 | C. | 呈碱性 | D. | 是纯水 |
科目:初中化学 来源: 题型:解答题
 在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.
在师生联谊晚会上,化学老师表演了“滴水生火”和“吹气生火”的魔术.用棉花将一些过氧化钠(Na2O2)包裹其中,用胶头滴管向棉花团中滴水,稍后棉花团剧烈燃烧起来.接着再用棉花将一些过氧化钠包裹其中,用一根玻璃导管向棉花团中吹气,稍后棉花团也剧烈燃烧起来.同学们很感兴趣,下课后,化学兴趣小组的同学对燃烧原因及一瓶白色过氧化钠固体的变质情况进行了如下探究.| 序号 | 实验操作 | 实验现象 | 结论 |
| 甲 | 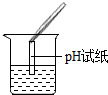 | 试纸变色,对比比色卡,pH>7 | 样品中一定含NaOH |
| 乙 | 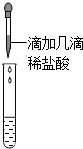 | 没有气体产生 | 样品中一定不含Na2CO3 |
| 丙 | 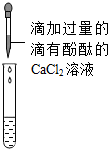 | 产生沉淀,且溶液变成红色 | 样品中含Na2CO3和NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ABC4 | B. | A3BC2 | C. | A4BC3 | D. | A2BC3 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 苹果酸中含有12个原子 | |
| B. | 苹果酸的相对分子质量为112 | |
| C. | 苹果酸中碳元素的质量分数约为41.4% | |
| D. | 苹果酸中C、H、O三种元素的质量比为4:4:4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “湿法炼铜”的化学原理可以表示为:Fe+CuSO4═FeSO4+Cu | |
| B. | 合金中一定含有金属元素 | |
| C. | 工业上用一氧化碳还原氧化铁制备铁,该反应属于置换反应 | |
| D. | 金矿中的金是以单质形式存在,用物理方法可以制得 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 称量完毕,把砝码放回砝码盒中 | |
| B. | 称量时左盘放称量物,右盘放砝码 | |
| C. | 将干燥的药品直接放在天平的托盘上称量 | |
| D. | 称量前将游码调到标尺的零刻度处,调节天平至平衡 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
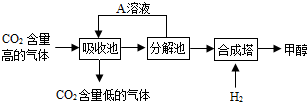
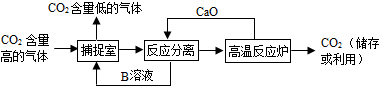
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com