

分析 (1)了解物质燃烧的三个条件.即物质具有可燃性、与空气接触、达到着火点;并结合题意分析解答;
(2)①铁生锈的条件是:与氧气接触,有水参加;
②刚煮沸蒸馏水中没有氧气;
③根据铝的性质来分析.
解答 解:(1)铜片上的白磷能够燃烧是因为与氧气接触,并到达着火点;水中的白磷温度达到着火点,但没有与空气接触,不能燃烧.所以我们可以得出结论:燃烧需要空气(氧气).铜片上的白磷和红磷都与空气接触,但红磷的着火点是240℃,热水不能到这个温度,所以红磷不能燃烧.
故答案为:燃烧需要空气(氧气);燃烧需要达到着火点;
(2)①甲中铁钉与空气和水共同接触,乙中没有水,丙中没有氧气,故甲表面生锈,铁生锈的条件是:与氧气接触,有水参加,二者缺一不可,故答案为:甲;铁与水和氧气共同作用;
②实验丙中用“刚煮沸并迅速冷却的蒸馏水”是为了除去水中溶解的氧气,使铁不能与氧气接触,故答案为:除去水中溶解的氧气,使铁不能与氧气接触;
③通常情况下铝制品很耐腐蚀,这是因为铝在常温下与空气中的氧气发生化学反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化;故填:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.
点评 本题通过实验探究了物质燃烧的三个条件,考查了学生对知识的掌握以及应用分析解答问题的能力,要根据题意细心分析.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①和② | B. | ③和④ | C. | 只有③ | D. | 只有④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 用“Y”形玻璃管(如图)做下列实验,在Ⅰ、Ⅱ支管中分别加入适量的物质及进行相应操作,不能达到实验目的是( )
用“Y”形玻璃管(如图)做下列实验,在Ⅰ、Ⅱ支管中分别加入适量的物质及进行相应操作,不能达到实验目的是( )| A. | 白磷、红磷;放入60℃水中;验证不同的物质着火点不同 | |
| B. | 25℃的饱和硝酸钾溶液、饱和石灰水;放入5℃水中;验证不同的物质溶解度受温度影响不同 | |
| C. | 生石灰、熟石灰;分别加入适量的水并滴入无色酚酞;验证两种物质都是碱 | |
| D. | 湿润的蓝色石蕊试纸、干燥的蓝色石蕊试纸;分别同入二氧化碳;验证二氧化碳与水反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
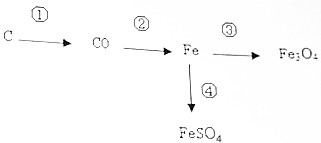 利用如图所示的转化关系,请回答:
利用如图所示的转化关系,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳是造成温室效应的主要气体 | |
| B. | “白色污染”是指一些白色垃圾造成的污染 | |
| C. | 二氧化硫是形成酸雨的气体 | |
| D. | 吸烟产生的一种有毒气体是一氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com