
| A. | ZnSO4溶液 | B. | 稀盐酸 | C. | AgNO3溶液 | D. | CuSO4溶液 |
分析 根据金属活动性顺序,验证金属的活动性顺序是否合理,可根据金属与酸、盐溶液“反应则活泼,不反应则不活泼”进行分析判断,通过分析方案所能得到的结论,确定是否能得出Zn、Cu、Ag三种金属的活动性顺序.
解答 解:A、在金属活动性顺序中,铜、银都在锌的后面,不能与硫酸锌反应,不能比较铜和银的活动性顺序,此方案不可行;
B、试剂中铜、银都不能与稀盐酸反应,无法比较金属铜与银的活泼性的大小,此方案不可行;
C、试剂中锌、铜都能与AgNO3溶液反应,无法比较金属锌与铜的活泼性的大小,此方案不可行.
D、锌可以置换CuSO4溶液中的铜而出现红色固体,证明锌的活动性比铜强;银和CuSO4溶液不反应,证明铜比银的活动性强.可以证明三种金属的活动性强弱,此方案可行;
故选D.
点评 同学们要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:实验探究题
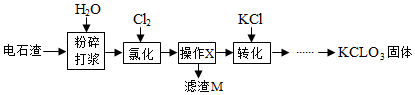
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、SO${\;}_{4}^{2-}$ | |
| B. | 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有Na+、OH-和SO${\;}_{4}^{2-}$ | |
| C. | 溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有OH-、SO${\;}_{4}^{2-}$,可能含有Na+ | |
| D. | 溶液中一定含有H+、Ba2+、Na+、Fe3+,一定不含有OH-、SO${\;}_{4}^{2-}$,可能含有Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 凉山州初中化学实验试题:向酸性硫酸铜溶液中(酸为硫酸)滴加氢氧化钠溶液,出现了如图关系.
凉山州初中化学实验试题:向酸性硫酸铜溶液中(酸为硫酸)滴加氢氧化钠溶液,出现了如图关系.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
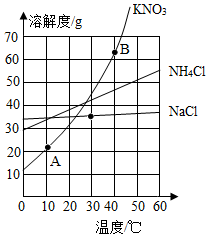 酸、碱、盐是重要的化合物,研究它们的性质有重要意义.
酸、碱、盐是重要的化合物,研究它们的性质有重要意义.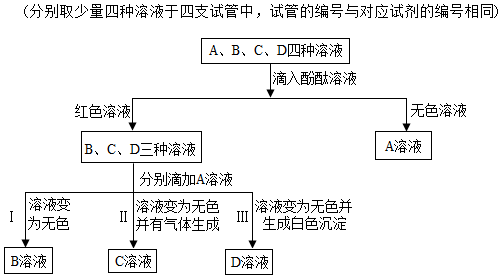
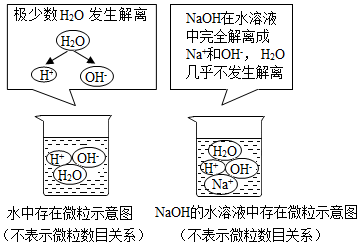
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
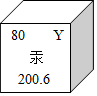
| A. | 原子核外有80个电子 | B. | 相对原子质量为200.6g | ||
| C. | 汞有毒,是非金属元素 | D. | 图中Y代表的是Ag |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
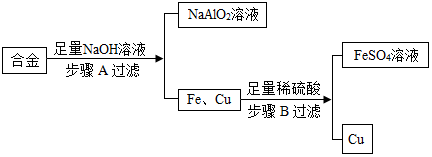
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com