



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
| A、乙酸乙酯属于氧化物 |
| B、每个分子由4个碳原子、8个氢原子和2个氧原子构成 |
| C、乙酸乙酯中碳、氢、氧三种元素质量比为6:1:4 |
| D、乙酸乙酯的相对分子质量为88 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
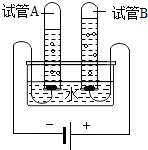 钓鱼岛是我国固有领土,钓鱼岛附近水域蕴藏着丰富的海底石油和天然气,并且是我国东海靖渔场,我国福建、浙江和台湾等地的渔民经常到这一带捕鱼.请回答:
钓鱼岛是我国固有领土,钓鱼岛附近水域蕴藏着丰富的海底石油和天然气,并且是我国东海靖渔场,我国福建、浙江和台湾等地的渔民经常到这一带捕鱼.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
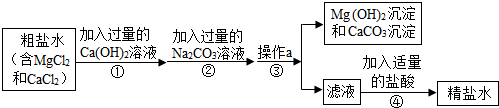
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、加热铜丝表面变黑,生成氧化铜 |
| B、铁丝在氧气中燃烧火星四射 |
| C、聚氯乙烯在空气中灼烧有刺激性气味 |
| D、硫在氧气中燃烧产生黄色火焰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com