

| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 |
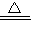 2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4
2K2MnO4+K2Mn4O8+4O2↑ b、KMnO4 KMnO2+O2↑
KMnO2+O2↑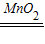 2H2O+O2↑,该反应不需加热,属于固液常温型,故选发生装置B;
2H2O+O2↑,该反应不需加热,属于固液常温型,故选发生装置B;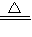 2K2MnO4+K2Mn4O8+4O2↑
2K2MnO4+K2Mn4O8+4O2↑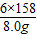 =
=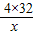
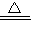 KMnO2+O2↑
KMnO2+O2↑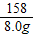 =
=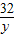
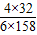 ≈0.135,b反应中失重率为:
≈0.135,b反应中失重率为: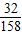 ≈0.201,可以发现,此时的失重率为18.0%,与b的失重率较为接近,故在43.9℃~377.9℃范围中,KMnO4分解反应主要以b为主;
≈0.201,可以发现,此时的失重率为18.0%,与b的失重率较为接近,故在43.9℃~377.9℃范围中,KMnO4分解反应主要以b为主; 2H2O+O2↑; B;
2H2O+O2↑; B; 

科目:初中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a a (H2O2质量分数)的H2O2溶液中 |
平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b b |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:
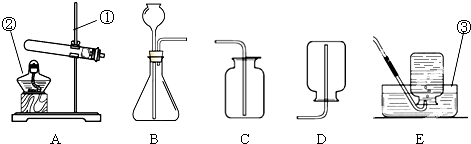
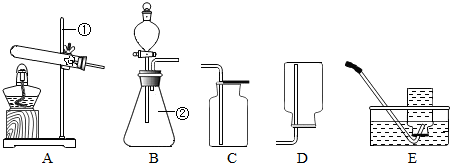
现有下列装置,回答问题:
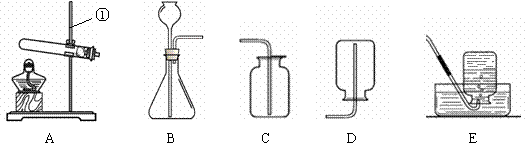 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
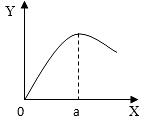
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com