某兴趣小组在实验室进行了“酸的性质”实验,使用过的试剂有:a铁、b氧化铁、c盐酸、d氢氧化钠和e碳酸钙,实验结束后将废物全部倒入废液缸中.
①测定废液的pH=1,说明废液呈________性.若将废液直接倒入用大理石制成的水斗中会造成危害,原因用化学方程式表示________.
②上述提供的5种试剂在废液中不可能存在的是________(填编号).
③废液中的溶质最多可能有________种.
④该兴趣小组用含0.02摩尔HCl的盐酸恰好中和20克的氢氧化钠溶液.
Ⅰ.计算20克氢氧化钠溶液中氢氧化钠的物质的量(根据化学方程式计算).________
Ⅱ.计算20克氢氧化钠溶液中溶质质量分数为________.
酸 CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑ abde 5 0.02mol 4%
分析:理解酸的化学性质,理清能够和酸发生反应的物质:酸碱指示剂、活泼金属、金属氧化物、碱和某些盐;根据方程式NaOH+HCl=NaCl+H
2O,利用0.02摩尔HCl的盐酸来计算消耗氢氧化钠的量即可,根据①计算的20克氢氧化钠溶液中氢氧化钠的物质的量,求算质量,进而计算质量分数.
解答:①废液的pH=1,说明废液呈酸性,因此废液中应有盐酸,盐酸和碳酸钙的反应为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
②由于溶液呈酸性,因此废液中应有盐酸,稀盐酸和铁、氧化铁、氢氧化钠溶液、碳酸钙都能反应,在废液中不可能存在;
③由于溶液呈酸性,因此废液中应有盐酸,稀盐酸和铁、氧化铁、氢氧化钠溶液、碳酸钙都能反应,即、NaOH+HCl=NaCl+H
2O,Fe+2HCl=FeCl
2+H
2↑,Fe
2O
3+6HCl=Fe(Cl)
3+3H
2O,CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑,故废液中溶质的种类最多可能有CaCl
2、NaCl、FeSO
4、Fe
2(SO
4)
3、Fe(Cl)
3共5种;
④设0.02摩尔HCl的盐酸恰好中和氢氧化钠的物质的量为x,则
NaOH+HCl=NaCl+H
2O,
1 1
0.02mol x
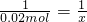
x=0.02mol
所以20克的氢氧化钠溶液中含有氢氧化钠的物质的量是0.02mol,氢氧化钠的质量是0.02mol×40g/mol=0.8g,所以20克氢氧化钠溶液中溶质质量分数=

×100%=4%.
故答案为:①酸;CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;②abde;③5;④Ⅰ、0.02mol;Ⅱ、4%.
点评:本题主要考查学生酸的化学性质以及利用化学方程式进行简单计算的能力,比较简单.

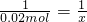
 ×100%=4%.
×100%=4%.

 名校课堂系列答案
名校课堂系列答案