
分析 (1)由题意可知,越活泼的金属,开发利用的越晚,说明主要和金属的活泼性有关;
(2)根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(3)根据铸造金币的物质的性质考虑;
(4)根据金属活动性顺序分析解答;
(5)铁与氧气和水充分接触时容易生锈,水和氧气同时存在是铁生锈的必要条件;显酸性的溶液、盐溶液能够促进金属生锈;
(6)根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气;锌与硫酸恰好完全反应,反应后溶液为硫酸锌溶液,根据反应的化学方程式,由金属锌的质量计算恰好完全反应消耗硫酸的质量,利用溶质质量分数公式计算稀硫酸溶液的质量;
解答 解:
(1)金属的活泼性越弱、金属的冶炼越容易,则其使用越早,与金属的导电性强弱、金属的含量无关,
(2)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)铸造硬币的合金需要具备耐磨性、抗腐蚀性好、具有一定的金属光泽,价格不易过于贵重,不需要考虑其导电性;
(4)由金属活动性表可知,三种金属活动性由强到弱的顺序:锌>铜>银,若滤渣中含有三种金属,说明锌有剩余,锌和硝酸银溶液反应生成硝酸锌和银,故其反应的化学方程式是:Zn+2AgN03=Zn(N03)2+2Ag.
若向滤液中滴加氯化钠溶液,有白色沉淀产生,说明了溶液中有硝酸银,则原滤液中所含有的溶质有硝酸银、硝酸锌;
(5)钢铁制品锈蚀的条件是与水和氧气充分接触.故填:与水和氧气充分接触.很多铁制品表面镀铝防锈,其原理是隔绝氧气;
(6)参加反应锌的质量为1t×32.5%=0.325t,
设消耗硫酸溶液质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
0.325t x÷20%
$\frac{65}{0.325t}=\frac{98}{x÷20%}$
x=2.45t
答案:
(1)③④;
(2)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)A;
(4)①Zn+2AgN03=Zn(N03)2+2Ag;②AgN03、Zn(N03)2;
(5)至少需要溶质质量分数为20%的稀硫酸2.45t.
点评 本题考查了金属的腐蚀与防护,非金属材料、有机高分子材料,侧重考查学生对基础知识的积累,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是某过氧化氢消毒液标签的部分内容,某医疗小分队用溶质质量分数为0.5%的过氧乙酸溶液对环境进行消毒,过氧乙酸中碳、氢、氧元素的质量比为6:1:12(填最简整数比);要配制溶质质量分数为0.5%的过氧乙酸溶液300kg,需要该过氧乙酸溶液10kg,配制过程中的主要步骤是计算、量取、溶解.
如图是某过氧化氢消毒液标签的部分内容,某医疗小分队用溶质质量分数为0.5%的过氧乙酸溶液对环境进行消毒,过氧乙酸中碳、氢、氧元素的质量比为6:1:12(填最简整数比);要配制溶质质量分数为0.5%的过氧乙酸溶液300kg,需要该过氧乙酸溶液10kg,配制过程中的主要步骤是计算、量取、溶解.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧:银白色固体燃烧,产生红色火焰,火星四射,放热,生成黑色固体 | |
| B. | 向滴有酚酞溶液的氢氧化钠溶液中通入足量二氧化碳后:溶液由红色变为无色 | |
| C. | 镁条在空气中燃烧:发出耀眼的白光,产生白烟,放热 | |
| D. | 铜丝放入硝酸银溶液中:紫红色固体表面覆盖一层银白色的银,溶液由无色变为蓝色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
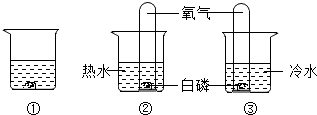
| A. | ①中水为热水 | B. | ②中白磷燃烧 | ||
| C. | ①和③对比可以得出燃烧的条件之一 | D. | ②和③对比可以得出燃烧的条件之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com