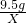硫酸钾(K2SO4)是一种常见钾肥,常含有一定量的杂质(假定杂质都是NaCI).某厂生产的硫酸钾包装袋上标有“K2SO4含量≥95%”.为判断“K2SO4含量≥95%”是否真实可信,取10克该硫酸钾样品进行检验.请你根据所给条件,逐步完成检测方案.(计算精确到0.1)
(1)如果通过测量BaSO4的质量来确定硫酸钾的含量,你必须选用的药品是:______(从HCl、BaCl2、NaOH、H2O中选择).
(2)你检测的原理是(用化学方程式表示):______
(3)通过计算回答,当BaSO4的质量是多少时,“K2SO4含量≥95%”是真实可信的.
解:(1)硫酸钾中只含有氯化钠,样品中没有钡元素,要使反应生成硫酸钡,选用的药品中应该含有钡元素,在提供的物质中,氯化钡中含有钡元素,应该选择氯化钡.
故填:BaCl
2.
(2)向样品中加入氯化钡时,硫酸钾能和氯化钡反应生成硫酸钡沉淀和氯化钾,反应的化学方程式为:K
2SO
4+BaCl
2═BaSO
4↓+2KCl.
故填:K
2SO
4+BaCl
2═BaSO
4↓+2KCl.
(3)解:设硫酸钡的质量为X,
当样品中硫酸钾的含量≥95%时,10g样品中硫酸钾的质量大于或等于:10g×95%=9.5g,
K
2SO
4+BaCl
2═BaSO
4↓+2KCl
174 233
9.5g X
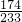
=
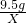
X=12.7g,
当硫酸钡的质量增大时,硫酸钾的质量也增大,硫酸钾的含量会更高,
所以,当BaSO
4的质量大于或等于12.7g时,“K
2SO
4含量≥95%”是真实可信的.
分析:能够和硫酸钾反应生成硫酸钡的物质中一定含有钡元素;
书写化学方程式要注意规范性;
通过化学方程式及其相关量可以判断某种说法说法正确.
点评:计算时,应该以95%为一个临界点进行计算,只要求出K
2SO
4含量为95%时硫酸钡的质量,其它问题就可以迎刃而解.

 =
=