
(8分)碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4)澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
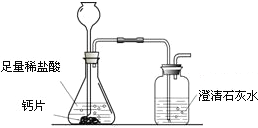
方案1:根据下图所示装置实验。

(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
【方案设计和实施】
(1)CaCO3 + 2HCl ===CaCl2 + H2O + CO2↑ ………………………………1分
(2)防止CO2气体逸出(液封) ……………………………………………1分
(3)夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好(必须答出操作、现象和结论才给分;答“先将长颈漏斗下部液封,将出口导管置于液面下,加热锥形瓶或用手捂住锥形瓶,有气泡产生,则证明该装置气密性良好”也给分) ……………………1分
【分析和评价】
(1)方案2 …………………………………………1分
澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少(建议答出因果关系) …………………………………………1分
(2)加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大(建议答出因果关系) ……………………………1分
(3)如何测定未知浓度(剩余)盐酸的量 ………………………………1分
【结论】有实验记录可知:加入300g盐酸时碳酸钙已完全反应,生成二氧化碳的质量为,(300+100+25)-418.4=6.6g
设xg碳酸钙与盐酸完全反应生成6.6g二氧化碳.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
xg 6.6g
100/ 44 =x /6.6
x=15
钙片中碳酸钙的质量分数为15/25 ×100%=60%.
60%
解析:通过资料:补钙剂中的糖类、维生素D等,这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,根据碳酸钙与稀盐酸反应生成二氧化碳的质量来测定钙片中碳酸钙的含量.


科目:初中化学 来源: 题型:阅读理解
 (4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
查看答案和解析>>
科目:初中化学 来源:2012年江苏省淮安市新马高级中学中考模拟化学试卷(1)(带解析) 题型:探究题
(8分)碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4)澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。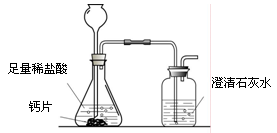
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1) 补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2) 碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3) 常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4) 澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
方案1:根据下图所示装置实验。

 | |||
| |||
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
碳酸钙可用于预防和治疗钙缺乏症。某实验小组同学要测定一种钙片中碳酸钙的含量。
【查阅资料】获得的资料有:
(1) 补钙剂中常加入糖类、维生素D等改善口感或增强药效。这些物质不![]() 与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
与稀盐酸反应产生气体,高温灼烧时会燃烧或分解。
(2) 碳酸钙高温灼烧分解生成氧化钙和二氧化碳。
(3) 常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量。
(4) 澄清石灰水中的Ca(OH)2含量很少,100 g澄清石灰水中最多含0.15 g Ca(OH)2。
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定。
![]() 方案1:根据下图所示装置实验。
方案1:根据下图所示装置实验。

 | |||
| |||
(1)锥形瓶中发生反应的化学方程式为 。
(2)长颈漏斗下部插入液面下的目的是 。
(3)加入药品前,检验该装置气密性的方法是 。
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25 g | 100 g | 200 g | 300.4 g |
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量。记录数据如下(空烧杯质量为100 g,加入钙片质量为25 g):
| 加入稀盐酸的质量 | 100 g | 200 g | 300 g | 400 g |
| 充分反应后烧杯及杯内物质总质量 | 222.8 g | 320.6 g | 418.4 g | 518.4 g |
【分析和评价】
(1)方案1和方案2中合理的是 ,原因是 。
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 。
(3)要使用【查阅资料】(3)中介绍的方法,还需要学习的是 。
【结论】经过计算,该钙片中碳酸钙的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com