


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 设计这一步骤的目的 |
| 1.用煮沸过的蒸馏水配制氢氧化钠溶液. | |
| 2.在氢氧化钠溶液中滴入酚酞,并在上方滴一些植物油. |
查看答案和解析>>
科目:初中化学 来源: 题型:
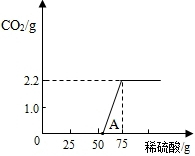
| 资料卡: 侯氏制碱法的原理可以表示为: NaCl+H2O+NH3+CO2 =NaHCO3↓+NH4Cl 2NaHCO3?Na2CO3+CO2 ↑+H2O该同学设计了如图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数.(水蒸气的影响忽略不计,夹持装置已略去)  主要实验步骤如下: ①按图组装仪器,并检查装置的气密性; ②称量5.5g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液; ③从分液漏斗滴入稀硫酸,直到不再产生气体时为止; ④缓缓鼓入一定量的N2; ⑤称量B瓶及溶液的质量,发现增重2.2g. 请回答下列问题: (1)写出A中发生反应的化学方程式 (2)鼓入一定量的N2的目的是 (3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) (4)该样品中碳酸钠的质量分数为 (5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 查看答案和解析>> 科目:初中化学 来源: 题型: (2010?莆田)Na2CO3俗名纯碱,其水溶液显碱性. [提出问题]一定温度下,Na2CO3溶液的碱性强弱与溶质质量分数之间有什么关系? [猜想]①溶质质量分数越大,碱性越强; ②溶质质量分数越大,碱性越弱; ③溶质质量分数越大,碱性不变. [设计实验] 步骤一:配制20℃时溶质质量分数分别为25%、5%、1%、0.2%的Na2CO3溶液. 步骤二:用精密pH试纸测定其pH,使用方法与普通pH试纸相同. 请回答下列问题: (1)称量Na2CO3固体粉末时,需用到的两种仪器是 托盘天平、药匙 托盘天平、药匙 .(2)用1%的Na2CO3溶液加水稀释为0.2%的溶液,如果两种溶液的密度都近似为1g/cm3,则应量取的1%溶液与水的体积比约为 1:4 1:4 .(3)某同学按以下操作测定pH:a、在桌面上放一小片精密pH试纸,b、将被测液滴到试纸上,c、把试纸显示的颜色与标准比色卡比较,即可得出其pH.你认为上述操作中错误的是 a a (填字母标号).(4)另一位同学按照正确操作,测得数据如下:
① ① (填序号)是正确的.查看答案和解析>> 科目:初中化学 来源: 题型:阅读理解 (2013?息县二模)碳和碳的氧化物是生活中常见的物质,也是初中化学学习的重要内容. (1)如图 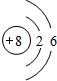 是,下列说法不正确的是 是,下列说法不正确的是B B .A.氧原子的质子数为8 B.氧原子在化学反应中易失去电子 C.氧是地壳中含量最多的元素 D.氧原子与氧离子的化学性质不同 (2)一氧化碳与二氧化碳性质不同的原因是什么? (3)实验室里,几位同学在制取二氧化碳. ①小刚同学用浓度为15%的稀盐酸与块状大理石反应制取二氧化碳,小明同学用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳,发现小刚同学收集到相同体积二氧化碳的速度比小同学快,由此你能得到的结论是 二者的分子结构不同 二者的分子结构不同 .②小平同学用加热碳酸氢钠的方法也能制得CO2,已知碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,请写出该反应的化学方程式 CO2+2NaOH═Na2CO3+H2O;Na2CO3+BaCl2═BaCO3↓+2NaCl CO2+2NaOH═Na2CO3+H2O;Na2CO3+BaCl2═BaCO3↓+2NaCl .(4)小明将氢氧化钠溶液与氯化钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请你用化学方程式解释可能的原因.(提示:BaCO3是白色、难溶于水) (5)一氧化碳和氢气虽然具有相似的化学性质,如还原性、可燃性等,但一氧化碳却不是新能源的发展方向,从安全和环保的角度来看,这其中的重要原因是什么? (6)称取5g石灰石(杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,将反应生成的气体全部通入有足量澄清石灰水的烧杯中(气体全部被吸收),反应结束后称量烧杯中物质的质量增加了1.76g.试计算石灰石中含有杂质的质量分数. 查看答案和解析>> 科目:初中化学 来源: 题型:阅读理解 (2013?滨湖区一模)某品牌纯碱中含有少量氯化钠.某化学探究小组为了测定该纯碱的纯度(即碳酸钠的质量分数),组内一同学设计了如下实验: 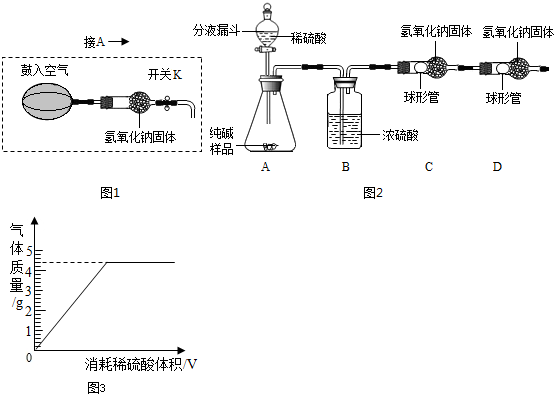 【设计实验方案】 实验装置(如图2所示,固定装置略去,装置内氢氧化钠固体均足量): 需要测定的实验数据:纯碱样品的质量;实验前后C装置的质量. (1)A装置中反应化学方程式是 Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ Na2CO3+H2SO4═Na2SO4+H2O+CO2↑ .为了保证纯碱样品中的碳酸钠完全反应,其操作是逐滴滴入稀硫酸至不再产生气泡为止 不再产生气泡为止 为止.(2)B、D装置的作用分别是 除去水蒸气 除去水蒸气 、防止空气中的二氧化碳和水蒸气进入C装置,影响实验结果 防止空气中的二氧化碳和水蒸气进入C装置,影响实验结果 .【交流与表达】 (3)图2所示实验装置会造成实验结果偏低,为了克服该不足,有同学提出:将A装置左端与图1装置相连接(须将A装置中双孔橡胶塞换成三孔橡胶塞),反应前、后分别用图1装置缓缓鼓入空气.具体操作是: ①反应前,断开B、C装置之间的连接,用图1装置鼓入一段时间的空气. ②反应后,再次用图1装置鼓入空气,目的是 用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体 用不含二氧化碳的空气排出残留在AB装置中反应产生的二氧化碳气体 .(4)组内另一位同学按照上述装置进行试验,在正确称量C装置的质量时,发现实验前后该装置的质量没有发生变化,可能原因是 装置漏气,产生的二氧化碳气体未被C中的氢氧化钠吸收 装置漏气,产生的二氧化碳气体未被C中的氢氧化钠吸收 .【数据处理】测定该品牌纯碱的纯度 (5)另取纯碱样品11.0g,加入足量稀硫酸充分反应.产生二氧化碳气体的质量与滴加稀硫酸的体积间数值关系如图3所示. 求:①反应生成CO2的质量为 4.4 4.4 g.②通过计算确定食用纯碱粉末中Na2CO3的质量分数.(写出计算过程,结果保留一位小数.) 【反思】 (6)若用稀盐酸代替稀硫酸将导致纯碱粉末的纯度 偏高 偏高 (填写“偏高”、“偏低”或“不变”).查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |