
| 操作步骤 | 预期实验现象 | 预期结论 |
| 另取适量样品溶液于试管中,滴加氯化钡溶液(或氯化钙溶液)至不再产生沉淀为止,静置;取上层清液,加入酚酞溶液. | 产生白色沉淀;溶液变红(或溶液不变色) | 氢氧化钠部分变质(或氢氧化钠全部变质) |
分析 根据已有的知识进行分析解答,氢氧化钠能与二氧化碳反应生成碳酸钠和水而变质,检验氢氧化钠是否变质实质上是检验碳酸钠的存在,碳酸钠的水溶液呈碱性,能与酸反应生成二氧化碳气体;检验氢氧化钠的变质程度就是检验是否含有氢氧化钠,需要先把碳酸钠除去,据此解答.
解答 解:(2)碳酸钠溶液呈碱性,也能使酚酞溶液变红,故加入酚酞溶液变红,不能证明未变质,故填:碳酸钠溶液呈碱性,也能使酚酞溶液变红;
(3)地加盐酸,有气泡产生,说明含有碳酸钠,氢氧化钠已经变质,故填:产生气泡;
【继续探究】要证明氢氧化钠是全部变质还是部分变质,关键是证明氢氧化钠的存在,首先加入过量氯化钡或氯化钙溶液除去碳酸钠然后加入酚酞试液观察溶液是否变红,若变红则是部分变质,若是不变色则是全部变质,故填:
| 操作步骤 | 预期实验现象 | 预期结论 |
| 滴加氯化钡溶液(或氯化钙溶液)至不再产生沉淀为止,静置;取上层清液,加入酚酞溶液 | 产生白色沉淀;溶液变红(或溶液不变色) | 氢氧化钠部分变质(或氢氧化钠全部变质) |
点评 本题考查的是氢氧化钠变质成分的探究,完成此题,可以依据已有的物质的性质进行.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液中有溶剂,所以溶液中一定有水 | |
| B. | 含有碳元素的化合物一定是有机物 | |
| C. | 金属都能与酸反应产生氢气 | |
| D. | 酸、碱中一定含有氢元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 甲乙丙三种固体物质的溶解度曲线如图所示,回答下列问题.
甲乙丙三种固体物质的溶解度曲线如图所示,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
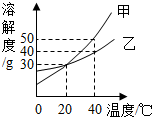 如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )| A. | 甲的溶解度等于乙的溶解度 | |
| B. | 20℃时,100g乙的饱和溶液中溶质质量是30g | |
| C. | 降低温度,有可能将甲的不饱和溶液变为饱和溶液 | |
| D. | 40℃时,分别用100g水配制甲、乙的饱和溶液,所需乙的质量大于甲的质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
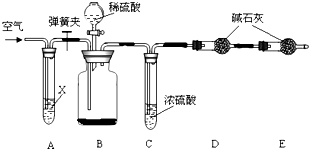 纯碱是重要化工原料
纯碱是重要化工原料| 实验步骤 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
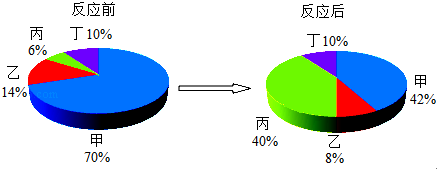
| A. | 丙可能是单质 | |
| B. | 在该反应中丁可能是催化剂 | |
| C. | 该反应是化合反应 | |
| D. | 反应中甲、乙、丙的质量比是14:3:17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com