
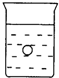
 在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示).向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应.在此实验过程中
在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示).向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应.在此实验过程中

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
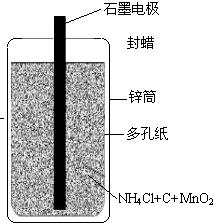 22、日常用的干电池构造、组成如图.某校化学活动小组正进行的研究性课题是
22、日常用的干电池构造、组成如图.某校化学活动小组正进行的研究性课题是查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
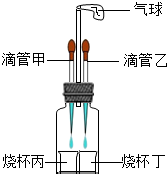 (2013?平顶山二模)如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.
(2013?平顶山二模)如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 实验步骤 | 实验现象 | 结论 |
| ①用 镊子 镊子 夹取一小块金属钠投入盛有稀CuSO4溶液的烧杯中 |
剧烈反应,生成蓝色沉淀和 无色(无味)气体 无色(无味)气体 |
猜想 2 2 不成立 |
| ②往反应后的溶液中加入足量的稀硫酸 | 沉淀完全溶解,烧杯底部无残留固体 | 猜想 1 1 成立 |
| 实验步骤 | 实验现象 | 结论 |
| ③将一小块金属钠投入盛有饱和 CuSO4溶液的烧杯中 |
反应更加剧烈,除出现与实验一相同的现象外,还生成了少量的黑色沉淀物 | 黑色沉淀物是 CuO(或氧化铜) CuO(或氧化铜) ,钠与CuSO4饱和溶液反应的产物中也没有铜 |
| ④ 往反应后的烧杯中加入足量的稀硫酸 往反应后的烧杯中加入足量的稀硫酸 |
蓝色沉淀和黑色沉淀物均完全溶解,烧杯底部无残留固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 反应阶段 | 1 | 2 | 3 | 4 | 5 |
| 现象 | 溶液颜色从无色变黄色 | 黄色逐渐加深并有少量气泡 | 气泡逐渐增多 | 气泡逐渐减少 | 反应停止 铁钉变亮 |
| 实验方法 | 可能观察到的现象 | 结论 |
用玻璃棒蘸取反应后的溶液滴在pH试纸上,并与标准比色卡对比. 用玻璃棒蘸取反应后的溶液滴在pH试纸上,并与标准比色卡对比. |
pH试纸的颜色与标准比色卡上pH为7处的颜色一致(浅黄色) pH试纸的颜色与标准比色卡上pH为7处的颜色一致(浅黄色) |
恰好完全反应 恰好完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图测所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题:
如图测所示,弹簧秤下挂着一重物A,烧杯中盛有溶液B,试根据要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com