
(12分) )某兴趣小组在学习碱的化学性质时,进行了如图所示的实验。

甲 乙 丙
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 ,这是因为 。
(3)丙实验中观察到的现象是 ,反应的化学方程式 。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个干净的废液缸中,最终看到废液缸中的废液浑浊并呈红色,由此产生疑问。
【提出问题】废液缸中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小兰认为:只有碳酸钠。小刚认为:只有氢氧化钙。小亮认为:是氢氧化钠和碳酸钠。
你认为还可能是 。(写一种猜想)
(1) HCl + NaOH ===NaCl+ H2O(2)气球膨胀(或气球体积增大);
二氧化碳被氢氧化钠溶液吸收,瓶内压强减小;(3)产生白色沉淀; Ca(OH)2+Na2CO3=====CaCO3↓+2NaOH(4) ①氯化钠 ②氢氧化钙和氢氧化钠
解析:(1)氢氧化钠与盐酸发生中和反应:HCl + NaOH === NaCl+ H2O;(2)乙实验中滴加氢氧化钠溶液后,瓶中的二氧化碳你被氢氧化钠部分吸收,使瓶内压强减小,瘪气球会胀大;(3)丙实验中碳酸钠会与氢氧化钙发生化学反应,生成白色沉淀碳酸钙,反应的方程式为:Ca(OH)2+Na2CO3=====CaCO3↓+2NaOH(4)①根据实验探究的步骤可推出:提出问题和交流讨论.①盐酸与氢氧化钠反应一定生成氯化钠,并且氯化钠显中性不与其它物质反应,所以一定含有氯化钠;②由于丙实验中是碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,所以可能含有氢氧化钠;因为废液显碱性,也可能含有氢氧化钙和氢氧化钠。


 寒假学与练系列答案
寒假学与练系列答案科目:初中化学 来源: 题型:阅读理解
| | 实验操作 | 实验现象 | 实验结论 |
| 猜想 | 在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | _____________________ | 猜想a、c不成立,猜想b成立。 |
| 探究 | ①用带火星的木条伸入过氧化钠与水反应的试管中 | 木条复燃 | 生成物有___________ |
| ②往①试管内的溶液中滴加___________ ______________ | _____________________ | 生成物有氢氧化钠 |

| 实验操作 | 实验现象 | 实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 | 木条复燃 | CO2在常温下能与过氧化钠反应,该反应的化学方程式为: ____________________________ |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 | 有气泡产生 石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源:2011年初中毕业升学考试(四川宜宾卷)化学 题型:探究题
(12分)某化学课外兴趣小组探究氢气还原氧化铜的反应,有如下实验装置:
(1)上述A装置可用于实验室制取氢气和二氧化碳,请分别写出实验室制取氢气和二氧化碳
的化学方程式 ; ;
上述可用于收集二氧化碳装置是 (用装置字母序号填空)。
(2)请你参与探究氢气还原氧化铜得到的红色固体的成分,完成下列各题:
已知信息:Ⅰ.氢气还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
①猜想假设:
假设一:红色固体只含Cu;假设二:红色固体只含Cu2O;
假设三: (请补充完成假设三)。
②实验探究:(填写表中空格)
| 实验操作 | 实验现象 | 实验结论 |
| a.取少量红色固体加入到足量硫酸溶液中 | 无明显现象 | 假设 成立 |
| b.取少量红色固体加入到足量硫酸溶液中 | | 假设二和假设三均成立 |
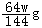 (选
(选 (选填>、<或=),则假设三成立。
(选填>、<或=),则假设三成立。查看答案和解析>>
科目:初中化学 来源:2011-2012学年河北衡水五校九年级第三次联考化学试卷(带解析) 题型:探究题
(12分)某化学兴趣小组为了探究铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行了如下探究活动:
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀的致密氧化膜。铬能与稀硫酸反应,生成氢气和硫酸铬(CrSO4)
【提出猜想】对这三种金属的活动性顺序提出了如下猜想:
猜想①:Cr>Al>Cu猜想②:Cr>Cu>Al 猜想③:Al>Cr>Cu 猜想④:Al>Cu>Cr
【讨论交流】根据已学的金属活动性顺序和已查阅的资料分析,肯定不能成立的是猜想 和猜想 (填序号)。
【实验设计及过程】请将表中的内容填写完整。
| 实验操作 | 实验现象 | 实验结论 |
| 室温下,将大小相同并打磨光亮的铬片、铝片、铜片分别浸入盛有体积相同、 相同的稀硫酸的试管中。 | 铬片表面产生气泡缓慢,铝片表面产生气泡较快,铜片表面 。 | 猜想 (填序号)成立。 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年内蒙古赤峰市宁城县九年级上学期期末测试化学试卷(解析版) 题型:探究题
(12分)某校化学兴趣小组的同学利用下列装置进行实验。

实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验。
(2)粗略测定加热2 g高锰酸钾所收集到的氧气体积。
反应原理:(用化学方程式表示)
(1)高锰酸钾制氧气:_______________________________________
(2)细铁丝在氧气中燃烧:_______________________________。
装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)
a→( )( ) →d
问题分析:
(1)实验过程发现B瓶中的水变红了,原因是:________________。
(2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作可能是:_______________________________________________________。
(3)本实验中,收集氧气的时机是加热后马上收集,若是在气体连续不断产生之后才开始收集,则测得的氧气的体积会比比实际值 (填“偏大”或“偏小”或“不变”)。
(4) 实验结束时,乙同学发现收集到的O2大于理论产量,针对这一现象,同学们进行了如下探究:
【提出猜想】猜想I:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2Mn04分解放出O2 。
做出上述两个猜想的理由是 。
【实验验证】同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的Mn02,在250℃条件下加热一段时间,冷却后测得Mn02的质量不变。则猜想________________错误。
②第二组同学取K2Mn04在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论。该组同学选择的实验方法是_________________ 。
查看答案和解析>>
科目:初中化学 来源:2011年初中毕业升学考试(四川宜宾卷)化学 题型:探究题
(12分)某化学课外兴趣小组探究氢气还原氧化铜的反应,有如下实验装置:

(1)上述A装置可用于实验室制取氢气和二氧化碳,请分别写出实验室制取氢气和二氧化碳
的化学方程式 ; ;
上述可用于收集二氧化碳装置是 (用装置字母序号填空)。
(2)请你参与探究氢气还原氧化铜得到的红色固体的成分,完成下列各题:
已知信息:Ⅰ.氢气还原氧化铜除生成铜外还可能生成氧化亚铜(Cu2O);Ⅱ.Cu和Cu2O均为不溶于水的红色固体;Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
①猜想假设:
假设一:红色固体只含Cu;假设二:红色固体只含Cu2O;
假设三: (请补充完成假设三)。
②实验探究:(填写表中空格)
|
实验操作 |
实验现象 |
实验结论 |
|
a.取少量红色固体加入到足量硫酸溶液中 |
无明显现象 |
假设 成立 |
|
b.取少量红色固体加入到足量硫酸溶液中 |
|
假设二和假设三均成立 |
③数据处理:甲同学称取Wg红色固体加入到足量硫酸溶液中使其充分反应后, (填操作名称)、洗涤、干燥,称量剩余红色固体质量为mg,通过计算,若m
 (选
(选
填>、<或=),则假设二成立;若m
 (选填>、<或=),则假设三成立。
(选填>、<或=),则假设三成立。
④交流与反思:只要假设合理,实验方法正确,根据实验现象和数据就能得出结论。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com