
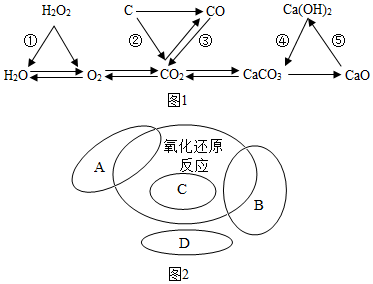
分析 (1)过氧化氢分解生成水和氧气,电解水生成氢气和氧气,碳酸钙分解生成氧化钙和二氧化碳,都属于分解反应;
氧化铜和碳反应生成铜和二氧化碳,属于置换反应;
氧化铁和一氧化碳反应生成铁和二氧化碳,氢氧化钙和二姨太反应生成碳酸钙沉淀和水,都不是基本反应类型;
碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应;
氢气燃烧生成水,碳燃烧生成二氧化碳,一氧化碳燃烧生成二氧化碳,氧化钙和水反应生成氢氧化钙,都属于化合反应;
(2)复分解反应不属于氧化还原反应,置换反应一定属于氧化还原反应,化合反应和分解反应一些属于氧化还原反应,一些不属于氧化还原反应.
解答 解:(1)①过氧化氢在二氧化锰催化作用下分解生成水和氧气,电解水生成氢气和氧气,碳酸钙在高温条件下分解生成氧化钙和二氧化碳,都属于分解反应,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
②高温条件下,氧化铜和碳反应生成铜和二氧化碳,属于置换反应,反应的化学方程式为:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
故填:2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
③高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,氢氧化钙和二姨太反应生成碳酸钙沉淀和水,都不是基本反应类型,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,Ca(OH)2+CO2═CaCO3↓+H2O.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,Ca(OH)2+CO2═CaCO3↓+H2O.
④碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
⑤氢气燃烧生成水,碳燃烧生成二氧化碳,一氧化碳燃烧生成二氧化碳,氧化钙和水反应生成氢氧化钙,都属于化合反应,反应的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,CaO+H2O═Ca(OH)2.
故填:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,CaO+H2O═Ca(OH)2.
(2)复分解反应不属于氧化还原反应,置换反应一定属于氧化还原反应,化合反应和分解反应一些属于氧化还原反应,一些不属于氧化还原反应,因此A是化合反应或分解反应,B是分解反应或化合反应,C是置换反应,D是复分解反应.
故填:化合反应,或分解反应;分解反应,或化合反应;置换反应;复分解反应.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.


科目:初中化学 来源: 题型:选择题
| A. | Zn2+、NH4+、NO3-、OH- | B. | H+、Na+、HCO3-、Cl- | ||
| C. | Ba2+、H+、Cl-、Fe2+ | D. | K+、Mg2+、NO3-、SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
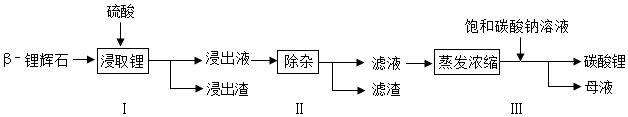
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气可用于炼钢--氧气具有可燃性 | |
| B. | 煤矿的矿井要通风、严禁烟火--可燃性气体遇明火发生爆炸 | |
| C. | 进入久未开启的菜窖,要先做灯火试验--二氧化碳有毒 | |
| D. | 铝制品比铁制品耐腐蚀--铝比铁化学性质稳定 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验次数 | 试剂 | 实验条件 | 实验现象 |
| 1 | 0.2克CuO粉末+6毫升pH=0的盐酸 | 常温 | 黑色粉末很快溶解,溶液呈蓝绿色 |
| 2 | 0.2克CuO粉末+6毫升pH=0的硫酸 | 常温 | 无明显现象 |
| 3 | 0.2克CuO粉末+6毫升pH=0的硫酸+0.35克NaCl | 常温 | 黑色粉末很快溶解.溶液呈蓝绿色 |
| 4 | 0.2克CuO粉末+6毫升pH=0的硫酸+0.35硫酸钠 | 常温 | 无明显现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
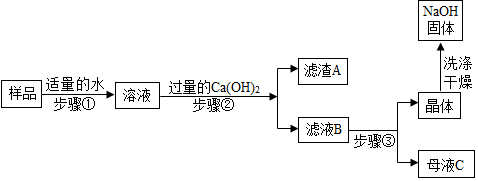
| 项目和次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
| 样品溶液质量(g) | 10 | 20 | 30 | 40 |
| 氯化钡溶液质量(g) | 10 | 15 | 15 | 30 |
| 产生沉淀的质量(g) | 1.97 | 3.94 | 3.94 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 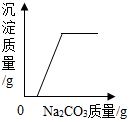 向氯化氢和氯化钙的混合溶液中加入碳酸钠溶液,生成沉淀质量的变化 | |
| B. | 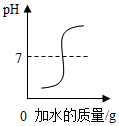 向硫酸中加水,溶液pH的变化 | |
| C. | 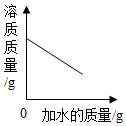 向饱和食盐水中不断加水,溶液中溶质的质量变化 | |
| D. | 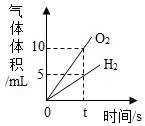 电解水生成气体的体积 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
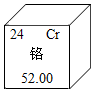 铬在元素周期表中信息如图所示,下列有关铬元素的说法正确的是( )
铬在元素周期表中信息如图所示,下列有关铬元素的说法正确的是( )| A. | 原子序数是24 | B. | 属于非金属元素 | ||
| C. | 一个铬原子核外有28个电子 | D. | 相对原子质量为52.00g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com