
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
分析 根据生石灰和碳酸钙均能与盐酸反应生成氯化钙的特点,氧化钙和碳酸钙中的钙元素都会与盐酸中的氯元素结合生成氯化钙进行分析.
解答 解:由于生石灰和碳酸钙均能与盐酸反应生成氯化钙,氧化钙和碳酸钙中的钙元素都会与盐酸中的氯元素结合生成氯化钙,
盐酸中的氯元素为:200g×7.3%×$\frac{35.5}{36.5}$=14.2g
设钙元素的质量为x
Ca------2Cl
40 71
x 14.2g
$\frac{40}{71}$=$\frac{x}{14.2g}$
x=8g
所以原固体中钙元素的质量分数为:$\frac{8g}{16g}$×100%=50%.
故选:C.
点评 此题属于质量守恒定律以及化学式计算考查题,解题的关键是能够分析出物质间反应的情况和反应前后元素质量不变的巧妙应用.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
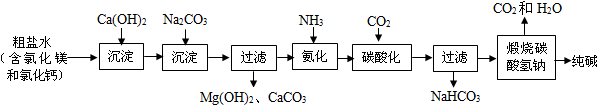
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 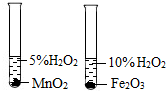 比较MnO2和Fe2O3的催化效果 | B. |  制取并收集CO2气体 | ||
| C. | 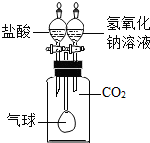 确认CO2和NaOH已发生反应 | D. | 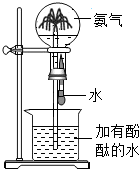 形成蓝色喷泉 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
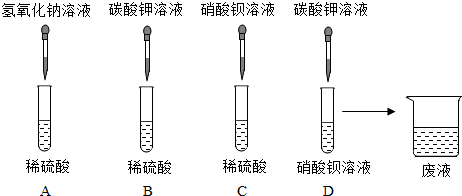
| 溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
| 可能含有Ba2+ | 向滤液中滴加稀硫酸 | 产生白色沉淀 | 含有该离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com