解:设稀释后硫酸的质量是x,消耗锌的质量是y
Zn+H
2SO
4=ZnSO
4+H
2↑
65 98 2
y x 0.2g
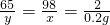
x=9.8g y=6.5g
设铜片的质量为z
Zn+CuSO
4=ZnSO
4+Cu△m(质量减小值)
65 64 1
z 7.5g-6.5g
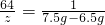
z=64g
根据质量守恒定律可知以上所求的铜的质量即为铜片与硫酸反应的铜的质量;
设与64g铜反应的硫酸的质量是wCu+2H
2SO
4(浓)

CuSO
4+SO
2↑+2H
2O
64 2×98
64g w
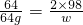
w=196g
所以原硫酸溶液的质量分数为:
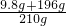
×100%=98%
答:原硫酸溶液的质量分数为98%
分析:根据题干中的叙述可知该硫酸溶液中的硫酸发生了两个反应①与铜的反应生成了硫酸铜;②与锌的反应生成了氢气,所以可依据氢气的质量计算②所消耗的硫酸的量,依据锌粉的质量减小值根据锌与硫酸铜的反应计算出铜的质量,进而得到①中反应的硫酸的量,而后利用溶质质量分数的计算解答即可;
点评:此题是一道化学计算综合题,解题的关键是利用常见的反应以及量差法对相关数值进行计算,从而解决了较为复杂的计算问题;

 CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)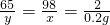
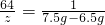
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O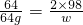
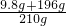 ×100%=98%
×100%=98%
